
| A. | CaCl2═Ca2++Cl2? | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2 OH- | D. | Na HCO3═Na++H++CO32- |
分析 A.氯离子不能合写;
B.硫酸为强电解质,完全电离;
C.钡离子为+2价离子;
D.碳酸氢根离子为弱酸的酸式根离子,不能拆.
解答 解:A.氯化钙为强电解质,完全电离,电离方程式:CaCl2═Ca2++2Cl?,故A错误;
B.硫酸为强电解质,完全电离,电离方程式:2SO4═2 H++SO42-,故B正确;
C.硫a(OH)2为强电解质,完全电离,电离方程式:Ba(OH)2═Ba+++2 OH-,故C错误;
D.碳酸氢钠为强电解质,完全电离,电离方程式:Na HCO3═Na++HCO3-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱是解题关键,注意离子符号的正确书写.


科目:高中化学 来源: 题型:选择题
| A. |  制备并检验氢气的可燃性 | B. |  除去CO2中的HCl | ||
| C. |  配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.04mol/L | C. | 0.02mol/L | D. | 0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、明矾、二氧化硫 | B. | 硝酸、烧碱、碳酸钙、氯化钠 | ||
| C. | 醋酸、苛性钠、碳酸钠、氨水 | D. | 盐酸、熟石灰、苛性钠、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 | B. | 原子总数 | C. | 碳原子数 | D. | 分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
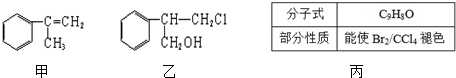
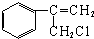 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙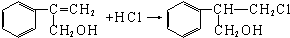 _(不需注明反应条件).
_(不需注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com