
| A | B | C | D | |
| 装置 |  |  H2(g)+I2(g)?2HI(g) |  |  |
| 目的 | 检验碳与浓硫酸反应的氧化产物 | 验证压强对化学平衡的影响 | 检查碱式滴定管是否漏液 | FeSO4溶液的蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳与浓硫酸反应生成二氧化碳、二氧化硫,二者均能使石灰水变浑浊,只有二氧化硫具有还原性;
B.H2(g)+I2(g)?2HI(g)为反应前后气体体积不变的反应;
C.图中操作为排出气泡;
D.硫酸亚铁易被氧化.
解答 解:A.碳与浓硫酸反应生成二氧化碳、二氧化硫,氧化产物为二氧化碳,足量高锰酸钾可除去二氧化硫,石灰水变浑浊可检验二氧化碳,故A正确;
B.H2(g)+I2(g)?2HI(g)为反应前后气体体积不变的反应,则改变压强平衡不移动,故B错误;
C.图中操作为排出气泡,检查碱式滴定管是否漏液时装水,观察是否漏液,故C错误;
D.硫酸亚铁易被氧化,FeSO4溶液的蒸发结晶得不到硫酸亚铁,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、化学平衡、氧化还原反应、仪器的使用等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
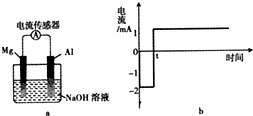 将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )
将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )| A. | 实验过程中,铝电极表面可能有气泡产生 | |
| B. | 0-t时刻,镁电极上发生反应:Mg-2e-+2OH-=Mg(OH)2 | |
| C. | t时刻时,铝和镁的金属活动性相同 | |
| D. | t时刻后,电池主要的总反应方程式:4Al+3O2+4OH-=4AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用于判断SO2能否与钡盐反应 | B. |  用于判断硼酸、碳酸的酸性强弱 | ||
| C. | 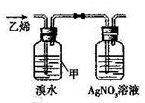 用于判断甲中发生的是加成反应 | D. | 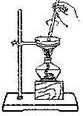 用于AlCl3的蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com