

 .
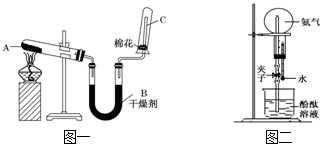
.分析 (1)将苯和溴的混合物滴入铁屑粉上后,铁屑和溴发生反应生成溴化铁,苯和液溴在溴化铁做催化剂条件下能发生取代反应生成溴苯;
(2)溴苯中的溴易挥发,非极性分子的溶质易溶于非极性分子的溶剂,据此分析苯的作用;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银;
(3)倒置漏斗或球形干燥管能防止溶液倒吸;
(4)溴化氢溶于水能得到氢溴酸,溴和水反应也可得到氢溴酸
解答 解:(1)将苯和溴的混合物滴入铁屑粉上后,铁屑和溴发生反应:2Fe+3Br2═2FeBr3,苯和液溴在溴化铁做催化剂条件下能发生取代反应生成溴苯,反应方程式为 ,
,
故答案为:2Fe+3Br2═2FeBr3, ;
;
(2)溴苯中的溴易挥发,溴和四氯化碳都是非极性分子,根据相似相溶原理知,溴易溶于四氯化碳,所以四氯化碳的作用是吸收溴蒸汽;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银,所以观察D和E两试管,看到的现象是D管中变红,E管中出现浅黄色沉淀,
故答案为:吸收Br2蒸汽;D管中变红;E管中出现浅黄色沉淀;
(3)当两端压力发生压力变化时,液体会产生倒吸现象,因为倒置的漏斗下口很大,液体上升很小的高度就有很大的体积,上升的液体的本身的压力即可低偿压力的不均衡.因此由于上部还有空气隔离,液体不会倒吸入上端的细管道,所以具有防倒吸作用的仪器有F;而D和E中导管没有插入液面下,故也有防倒吸的作用,故答案为:DEF;
(5)溴化氢溶于水能得到氢溴酸,溴和水反应也可得到氢溴酸,如果没有C装置,无法判断该反应中是否有溴化氢生成;苯溶解了溴,除去的溴的干扰,所以能判断该反应有溴化氢生成,故答案为:除去Br2的干扰.
点评 本题考查了苯的取代反应实验,考查的知识点有反应方程式的书写、产物的判断、蒸汽的成分及性质,综合性较强,难度较大,注意苯能和液溴发生取代反应,和溴水不反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g氢气所含原子数目为NA | |
| B. | 标准状况下,11.2L H2O所含分子数为0.5NA | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. | 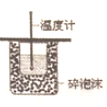 装置依据测定酸碱中和反应的中和热 | |
| C. | 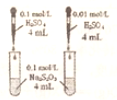 装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. | 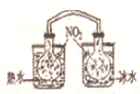 装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在煤油层上,不反应 | |
| B. | 钠沉在煤油层下,不反应 | |
| C. | 钠沉在煤油层下浮在水层上,在交界处剧烈反应 | |
| D. | 钠沉在水层下剧烈反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com