
| 0.5mol/L |
| 2min |
| 0.5mol/L |
| 2min |
| 1mol/L |
| 5mol/L |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、双原子分子中的共价键,一定是极性键 |
| B、非极性键也可能存在于离子化合物中 |
| C、物理变化可能破坏化学键 |
| D、离子化合物在固态时不能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-丁烯不存在顺反异构体 |
| B、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 |
C、菲的结构简式为 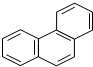 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 |
| D、乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 简单实验方案 | 预测的实验现象 | 结论 |
| 假设 | ||
| 假设 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
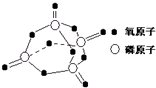 (1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式
(1)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com