
分析 (1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,根据方程式计算第一步反应生成氢气体积,第二步参加反应甲烷为1m3×20%=0.2m3,根据方程式计算第二步反应生成氢气体积,二者之和为生成氢气总体积,再根据n=$\frac{V}{{V}_{m}}$计算;
(2)根据C元素守恒计算生成二氧化碳的物质的量,再根据K2CO3+CO2=2KHCO3计算需要K2CO3的质量,结合溶解度计算溶液质量;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,进而计算所得硝酸溶液的质量分数,根据方程式计算生成HNO3、水的质量,可得得到硝酸溶液质量,再根据稀释中HNO3质量不变计算稀释后溶液质量,进而计算加入水的质量;
(4)①设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg,根据溶质质量不变用M1、M2分别表示出x、y,结合M1+M2=x+y进行解答;
②结合①中表达式分析解答,由于H2O流失5%,则此时(x+y)=(M1+M2)×95%.
解答 解:(1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,由CH4+H2O→CO+3H2可知,第一步反应生成氢气体积为3×0.8m3=2.4m3,第二步参加反应甲烷为1m3×20%=0.2m3,由2CO+CH4+2O2→3CO2+2H2可知,第二步反应生成氢气体积为2×0.2m3=0.4m3,故生成氢气总体积为2.4m3+0.4m3=2.8m3,标况下得到气体体积为$\frac{2800L}{22.4L/mol}$=125mol,
故答案为:125;
(2)根据C元素守恒,生成二氧化碳的物质的量为$\frac{1000L}{22.4L/mol}$=$\frac{1000}{22.4}$mol,由K2CO3+CO2=2KHCO3可知,需要K2CO3的质量为$\frac{1000}{22.4}$mol×138g/mol,需要饱和K2CO3溶液质量为:$\frac{1000}{22.4}$mol×138g/mol÷$\frac{110}{110+100}$=11761g,
故答案为:11761;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,所得硝酸溶液的质量分数=$\frac{63g}{63g+18g}$×100%=77.78%,
NH3+2O2=HNO3+H2O
17 63 18
1.7吨 6.3吨 1.8吨
稀释可得50%的硝酸为$\frac{6.3吨}{50%}$=12.6吨,故需要加入水的质量为12.6吨-6.3吨-1.8吨=4.5吨,
故答案为:77.78;4.5;
(4)①解:设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg
则x=$\frac{63.5%{M}_{1}}{97.7%}$,y=$\frac{98%{M}_{2}}{49%}$
因为M1+M2=x+y
所以$\frac{63.5%{M}_{1}}{97.7%}$+$\frac{98%{M}_{2}}{49%}$=M1+M2,
整理可得$\frac{{M}_{1}}{{M}_{2}}$=$\frac{20}{7}$,
答:$\frac{{M}_{1}}{{M}_{2}}$的值为$\frac{20}{7}$;
②所以$\frac{63.5%{M}_{1}}{97.7%}$+$\frac{98%{M}_{2}}{49%}$=(M1+M2)×95%,
整理可得$\frac{{M}_{1}}{{M}_{2}}$=$\frac{7}{2}$>$\frac{20}{7}$,配料比应增大,
答:配料比应增大.
点评 本题考查化学计算,题目计算量大、过程复杂,属于易错题目,侧重考查学生分析计算能力,难度较大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
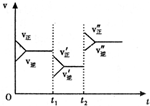
| A. | t1时若是降温使速率变化,则正确反应是放热反应 | |
| B. | t2时若是加压使速度变化,则A、B、C、D均为气体 | |
| C. | t2时改变的条件可能是加入催化剂 | |
| D. | t2时改变的条件可能是增大反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
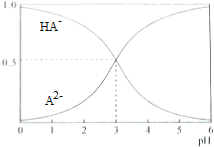
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
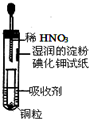
| A. | 吸收剂可以是NaOH溶液 | B. | 试管上部的气体始终为无色 | ||
| C. | 小试管中溶液最终呈蓝色 | D. | 试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mlCuSO4溶液的试管里加入2mlNaOH溶液,观察现象 | Cu2++2OH-═Cu(OH)2↓ |
| Ⅱ.向盛有2mL pH=1的HCl溶液的试管里慢慢滴入18mL(已足量)CH3COONH4溶液(查资料知CH3COONH4,溶液呈中性 )震荡摇匀,测得pH≈3.7 | |
| Ⅲ向盛有2mLNaHCO3溶液的试管里加入2mL H2SO4溶液,观察现象 | HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
| Ⅳ向盛有2mL 稀Na2SO4溶液的试管里加入2mL稀KCl溶液,观察无明显现象 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 定样品中Na2O2的含量.
定样品中Na2O2的含量.
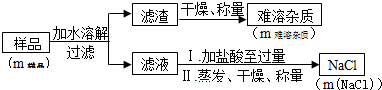
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com