

| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
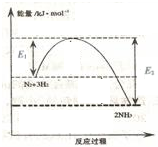
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,
A.金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故A错误;
B.石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C.因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故C正确;
D.依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量大于1.9 kJ,故D错误.
故选C.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.


科目:高中化学 来源: 题型:解答题
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
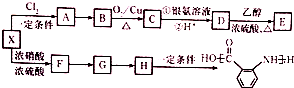
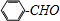 ;
; ;②
;②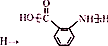 :
: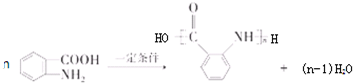 ;
;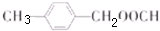 ;
;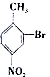 合成
合成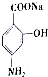 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
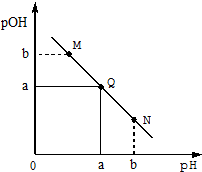 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com