
【题目】甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g)![]() C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
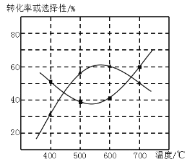
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
【答案】+41.0kJ/mol 较低温度 Cu2O+CO![]() 2Cu+CO2 BCD 0.16875
2Cu+CO2 BCD 0.16875  CO2+6e-+6H+=CH3OH+H2O
CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)根据盖斯定律计算待求反应的反应热;
(2)根据反应自发性判断依据分析,从平衡移动角度分析CO2存在对催化剂的影响;
(3)根据平衡状态时任何物质的物质的量、浓度及含量保持不变,分析判断;
(4)根据图示可知反应在600℃时甲醇转化率是60%,根据反应开始时的物质的量浓度,物质的反应关系计算平衡常数,利用该反应的正反应是气体体积增大的反应,增大压强,平衡向气体体积减小的方向移动分析;
(5)根据反应中元素化合价的变化及物质书写电极反应式;
(1)由于反应热与反应途径无关,只与反应的物质的始态和终态有关,所以反应I-反应III,整理可得CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=△H1-△H1=-49.0kJ/mol-(-90.0kJ/mol)=+41.0kJ/mol;
CO(g)+H2O(g) △H2=△H1-△H1=-49.0kJ/mol-(-90.0kJ/mol)=+41.0kJ/mol;
(2)反应III的正反应是气体体积减小的放热反应,根据反应自发进行的判断依据△G=△H-T△S<0,反应可自发进行,则若反应自发进行,由于△H<0,△S<0,所以反应温度要在低温条件下才符合△G<0的条件;
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g)在催化剂Cu2O存在条件下进行,体系中同时存在反应Cu2O+CO
CH3OH(g)在催化剂Cu2O存在条件下进行,体系中同时存在反应Cu2O+CO![]() 2Cu+CO2,若反应体系中含少量CO2,则增大了生成物的浓度,平衡逆向移动,可以产生该反应的催化剂Cu2O,使催化剂的量保持不变,因而可使反应速率可大大加快;
2Cu+CO2,若反应体系中含少量CO2,则增大了生成物的浓度,平衡逆向移动,可以产生该反应的催化剂Cu2O,使催化剂的量保持不变,因而可使反应速率可大大加快;
(3)对于反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的正反应是气体体积减小的放热反应。
CH3OH(g)+H2O(g),该反应的正反应是气体体积减小的放热反应。
A.反应混合物都是气体,气体的质量、体积都不变,因此密度始终不变,因此不能据此判断反应为平衡状态,A错误;
B.反应前后气体的物质的量改变,而气体的质量不变,若混合气体的平均相对分子质量不再变化,说明反应处于平衡状态,B正确;
C.CO2的生成速率与CH3OH的生成速率相等,则任何一种物质的浓度不变,反应达到平衡,C正确;
D.容器的压强不再变化,说明气体的物质的量不变,反应达到平衡状态,D正确;
故合理选项是BCD;
(4)根据图示可知反应在600℃时甲醇转化率是60%,在反应开始时c(CH3OH)=0.25mol/L,达到平衡时c(CH3OH)=0.25mol/L(1-60%)=0.10mol/L,c(C3H6)=0.25mol/L×60%×![]() =0.050mol/L,c(C3H6)=0.25mol/L×60%=0.15mol,则该反应的化学平衡常数K=
=0.050mol/L,c(C3H6)=0.25mol/L×60%=0.15mol,则该反应的化学平衡常数K=![]() =0.16875;由于该反应的正反应是气体体积增大的反应,所以在其它条件不变时,若将容器的体积由2L变为1L,即增大了体系的压强,化学平衡向气体体积减小的逆反应方向移动,导致甲醇平衡转化率降低,用图像表示为:
=0.16875;由于该反应的正反应是气体体积增大的反应,所以在其它条件不变时,若将容器的体积由2L变为1L,即增大了体系的压强,化学平衡向气体体积减小的逆反应方向移动,导致甲醇平衡转化率降低,用图像表示为: ;
;
(5)CO2在酸性条件下,在阴极被还原产生CH3OH,反应方程式为:CO2+6e-+6H+=CH3OH+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为___,向反应后溶液中加_______溶液得到KIO3。

(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式__________。
②电解过程中通过阳离子交换膜的离子主要为_____,其迁移方向是_______(用A、B表示)。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有_______(写出一点)。
(3)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加____盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为_________。
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量____mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。

下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:


实验步骤: 在A中加入4.4 g异戊醇(![]() ),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是_________________。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是___________。
(4)分液漏斗在使用前须清洗干净并_______,在洗涤、分液操作中,应充分振荡,然后静置,待分层后_________________(填标号),
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)本实验中加入过量乙酸的目的是_________________。
(6)实验中加入少量无水MgSO4的目的是_____________。
(7)在蒸馏操作中,仪器选择及安装都正确的是_____________ (填标号) 。

(8)本实验的产率是_____________
a. 30% b. 40% c. 50% d. 60%
(9)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏_____________ (填“高”或“低”),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究无机盐X(仅含三种元素,摩尔质量为270g·mol-1)的组成和性质,某学习小组进行了如下实验,其中气体单质A能使带火星的木条复燃。
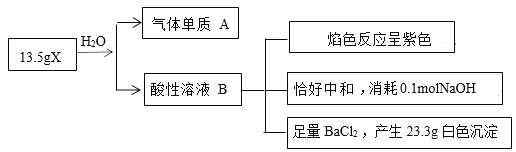
(1)X的组成元素为O和______(用元素符号表示)。
(2)写出X与水反应的化学反应方程式__________。
(3)X氧化能力极强,且对环境友好,可用于脱硫、脱硝。在碱性条件下,X氧化SO32-的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. ClO3-的空间构型为平面三角形
B. SiF4和SO32-的中心原子均为sp2杂化
C. C2H2分子中σ键与π键的数目比为1︰1
D. SF6中有6对相同的成键电子对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com