
【题目】2.8g铁与100 mL稀硫酸恰好完全反应,反应前后溶液体积的变化忽略不计。求:
(1)产生的气体在标准状况下的体积。_______
(2)反应完全后,所得溶液中亚铁离子的物质的量浓度。_______
(3)反应前溶液中H+物质的量溶度。_______
【答案】1.12L 0.5mol/L 1mol/L
【解析】
(1)2.8g铁,其物质的量为![]() =0.05mol,根据反应Fe+H2SO4=FeSO4+H2↑可知,0.05molFe共生成0.05mol氢气,则产生的气体在标准状况下的体积为0.05mol×22.4L=1.12L;
=0.05mol,根据反应Fe+H2SO4=FeSO4+H2↑可知,0.05molFe共生成0.05mol氢气,则产生的气体在标准状况下的体积为0.05mol×22.4L=1.12L;
(2)2.8g铁,其物质的量为![]() =0.05mol,根据反应Fe+H2SO4=FeSO4+H2↑可知,0.05molFe共生成0.05mol FeSO4,所得溶液中亚铁离子的物质的量浓度为
=0.05mol,根据反应Fe+H2SO4=FeSO4+H2↑可知,0.05molFe共生成0.05mol FeSO4,所得溶液中亚铁离子的物质的量浓度为![]() =0.5mol/L;
=0.5mol/L;
(3)恰好完全反应,硫酸的物质的量为0.05mol,则稀硫酸的物质的量浓度为![]() =0.5mol/L,则c(H+)=2 c(H2SO4)=2×0.5 mol/L= 1mol/L;
=0.5mol/L,则c(H+)=2 c(H2SO4)=2×0.5 mol/L= 1mol/L;


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】已知反应:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol1;②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol1。下列结论中正确的是( )
A. 碳的燃烧热ΔH<-110.5kJ·mol1
B. ①的反应热为221kJ·mol1
C. 稀醋酸与稀氢氧化钠溶液反应生成1mol水,放出57.3kJ热量
D. 由②可知稀溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺W会导致贫血症状。
(1)写出AE4的电子式:____________________。
(2)下列事实能用元素周期律解释的是(填字母序号)___________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.WE3的溶液可用于刻蚀铜制的印刷电路板
(3)NaCN是一种有剧毒的盐,用E的一种氧化物EO2可以除去水溶液中含有的该有毒物质,得到一种生活中常见的固体和两种无毒气体。写出该反应的离子方程式:_________________________________________。
(4)工业上用电解法制备D的单质,反应的化学方程式为_____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
①上述反应的离子方程式为___________________________________________。
②D的单质与X在高温下反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
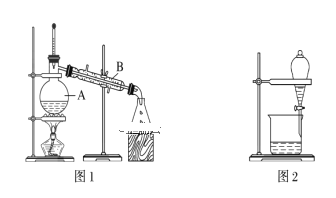
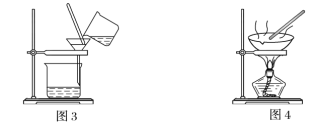
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是_______________________。下列关于以上实验操作说法一定正确的是_____。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使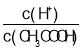 值增大
值增大
B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1 mol·L-1某一元酸HA溶液中![]() =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。已知:Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
ZnSO4+2H2O+SO2↑。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解。
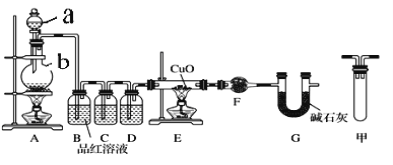
①填写仪器名称:a___________、b___________。
②研究小组认为还可能产生氢气的理由是:_____________________。
③装置D中加入的试剂是__________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是______________________________。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄人后对人体有一定的危害,其结构可表示为![]() (其中R为烃基)实验室由以下方法可得到DMP。
(其中R为烃基)实验室由以下方法可得到DMP。
![]()
请回答:
(1)物质C中官能团的名称为_____。
(2)下列有关DMP的说法可能正确的是_______。(填字母标号)
A.DMP的分子式为C10H12O4
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸(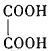 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为______。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为______。
(4)工业上以邻二甲苯(![]() )为原料先生产苯酐(
)为原料先生产苯酐(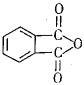 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为________。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为________。
(5)芳香化合物E与C互为同分异构体,若lmo E与足量银氨溶液反应最多生成2mol Ag,则E可能的结构简式为______。B也存在多种同分异构体,符合下列条件的B的同分异构体有______种。
①l mol有机物可以与2mol NaOH反应
②苯环上的一氯代物只有一种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com