
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X是元素周期表中原子半径最小的元素,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。 请回答下列问题:
(1)Y在元素周期表中的位置为 ,ZX的电子式为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作消毒剂的有 、 (写出其中两种物质的化学式)。
(4)X2M的标准燃烧热ΔH=-a kJ·mol-1,写出表示X2M标准燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
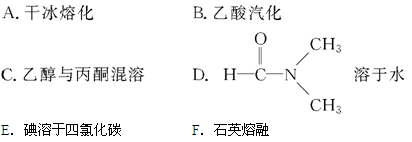
(1)可正确表示原子轨道的是 。
| A.2s | B.2d | C.2px | D.3f |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:________。
(2)Cm-和E(m-1)-的还原性强弱为________>________,能证明其还原性强弱的离子方程式为________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为________。
(5)在B、C、E单质中,符合下列转化关系的是________。
单质 化合物一
化合物一 化合物二
化合物二 最高价氧化物
最高价氧化物
对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.已知几种元素原子的价电子构型为3s2,4s2,4s24p1,3d54s2,3s23p3,它们分别属于第几周期?第几族?最高化合价是多少?各元素符号分别是什么?
Ⅱ.第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依次增大。已知A与B 的次外层电子数均为8,而C与D的次外层电子数均为18。根据原子结构,判断:
(1)A、B、C、D的元素符号分别是________、________、________、________。
(2)写出D与A的简单离子的电子排布式________,________。
(3)哪一种元素的氢氧化物碱性最强?__________________________________________。
(4)B与D两原子间能形成何种化合物?________________。写出化学式及电子式________________,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号:
A________,C________,D________。
(2)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式__________________________________________________;
A、E两元素最高价氧化物对应的水化物相互反应的化学方程式________________________。
(3)比较C、D最高价氧化物对应水化物的酸性________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com