
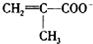
 )、Cl-、H2O形成的配合物为
)、Cl-、H2O形成的配合物为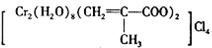 .
.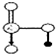 是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是
是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是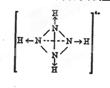 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:8 |
| C、反应过程中转移的电子数为4e- |
| D、化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
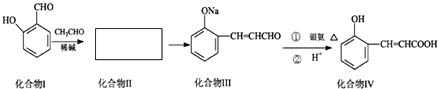

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HBr | AgNO3 | BaCl2 | KOH |
| pH变化 | 变小 | 变大 | 不变 | 变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
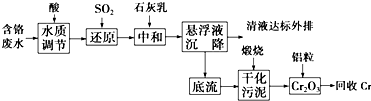 含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.查看答案和解析>>
科目:高中化学 来源: 题型:
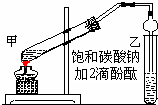 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| X | 2080 | 4000 | 6100 | 9400 |
| Y | 500 | 4600 | 6900 | 9500 |
| Z | 740 | 1500 | 7700 | 10500 |
| M | 580 | 1800 | 2700 | 11600 |
| N | 420 | 4100 | 6400 | 8900 |
| A、X和Y | B、Y和N |
| C、M和N | D、Y和M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验现象 | 实验结论 |
| A | 氯水呈浅绿色 | 氯水中含有含有Cl2 |
| B | 向FeCl2溶液中滴加氯水,溶液变成棕黄色 | 氯水中含有HClO |
| C | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀 | 氯水中含有Cl- |
| D | 向氯水中加入NaHCO3粉末,有气泡产生 | 氯水中含有H+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com