
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
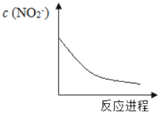
A.随着反应的进行,溶液中的H+浓度减小B.反应的氧化剂是NO3-
C.消耗1 mol氧化剂,转移电子6NAD.氧化性:Cr2O72->NO3-
【答案】B
【解析】
氧化还原反应遵守电子得失守恒,表现为化合价升降相等。根据题给信息,结合图可知,NO2-被消耗,是反应物,变化为NO2- →NO3-,化合价升高,发生氧化反应,则含Cr粒子化合价降低,发生还原反应,变化为Cr2O72- →Cr3+。再根据电子守恒确定,电荷守恒,质量守恒,可写出离子方程式为:Cr2O72- +3NO2- +8H+ =3NO3- +2Cr3+ +4H2O,可在此基础上对各选项作出判断。
A. 反应的离子方程式为:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3+ +4H2O,反应消耗H+,所以,随着反应的进行,溶液中的H+浓度减小,A选项正确;
B. 根据反应的离子方程式为可知,氧化剂是Cr2O72-,NO3-是氧化产物,B选项错误;
C. 消耗1 mol氧化剂Cr2O72-,转移电子数等于得电子数,为:1 mol×2×3 NA mol-1= 6NA,C选项正确;
D. 氧化剂是Cr2O72-,NO3-是氧化产物,氧化剂的氧化性大于氧化产物的氧化性,D选项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
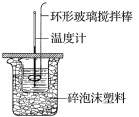
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___。
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=___(结果保留一位小数)。
(4)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、F为金属单质,C是淡黄色粉末,M有磁性,回答下题。
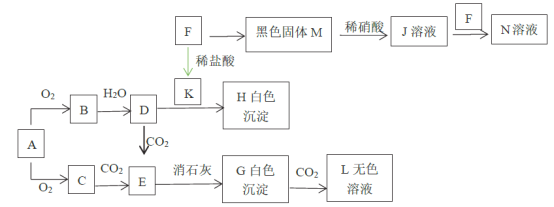
已知:2Na2O2+2CO2=2Na2CO3+O2
(1)写出下列物质的化学式。C____________L_______
(2)用玻璃棒蘸取少量无水CuSO4与熔化的A接触,瞬间产生耀眼的火花,同时有红色物质生成,写出该反应的化学反应方程式__________,在该反应中,氧化剂是____________。
(3)已知氧化性:HNO3>Fe3+,稀硝酸的还原产物是NO,写出固体M与稀硝酸反应的离子方程式________。
(4)写出J与F混合的化学反应方程式:_______。
(5)写出L与足量的D反应的离子方程式:__________。
(6)向1 L 0.2 mol/L的D溶液中通入CO2气体3.36 L(标准状况),所得溶液中的溶质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置测定CaCO3和稀盐酸反应的反应速率,开始时电子秤的示数为225.8 g,50 s后示数为223.6 g,则50 s内此反应的平均反应速率v(HCl)为(假定反应过程中溶液体积不变,且药品足量)( )
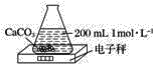
A.0.01 mol·L-1·s-1
B.0.05 mol·L-1·s-1
C.0.02 mol·L-1·s-1
D.0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物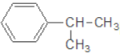 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A.它难溶于水,但易溶于苯
B.它会使酸性高锰酸钾溶液褪色
C.该物质含苯环的同分异构体(不包括它本身)共有5种
D.一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
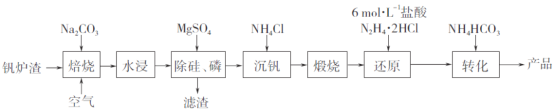
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com