
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
A. 平衡常数约为0.25
B. B的转化率为50%
C. A的平均反应速率为0.25 mol/( L·min)
D. 若反应前后压强之比为4:3则表明该反应达到平衡状态
【答案】D
【解析】
在一定条件下,将3mol A和1mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,生成1.0molD,并测得C的浓度为0.25mol/L,C物质的量为0.25mol/L×2L=0.5mol,利用三段式列式计算。
在一定条件下,将3mol A和1mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,生成1.0molD,并测得C的浓度为0.25mol/L.C物质的量为0.25mol/L×2L=0.5mol。
2A(g)+B(g)xC(g)+2D(g)
起始量(mol) 31 0 0
变化量(mol) 1 0.5 0.5x 1
平衡量(mol) 2 0.5 0.5x 1
0.5x=0.5mol,x=1。
A.平衡常数K=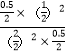 =0.25,故A正确;
=0.25,故A正确;
B.B的转化率=![]() ×100%=50%,故B正确;
×100%=50%,故B正确;
C.A的平均反应速率=![]() =0.25 mol/( Lmin),故C正确;
=0.25 mol/( Lmin),故C正确;
D.气体压强之比等于气体物质的量之比,反应前后压强之比=4∶(2+0.5+0.5+1)=1∶1,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】如图是一个铜锌双液原电池装置图,下列说法正确的是
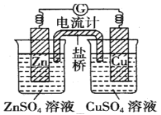
A. 盐桥中的阴离子向CuSO4溶液中移动
B. 盐桥的作用之一是平衡电荷
C. 铜片作电池的负极
D. 电子从锌电极经溶液流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
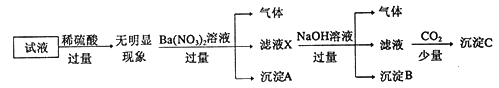
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。

(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
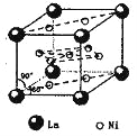
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com