
下列实验方法或装置正确的是( )

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
科目:高中化学 来源: 题型:填空题
 已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.
已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在水中加入下列物质 ,可使水的电离平衡正向移动的是( )
,可使水的电离平衡正向移动的是( )
A.NaOH B.NH4Cl C.NaCl D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I.制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1) 装置③的作用是 。
(2) 装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
① 减压,55 ℃蒸发结晶;② 趁热过滤;③ ;④ 低于60 ℃干燥,得到成品。
实验II.测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
① 确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2- + 4 I- + 4 H+ = 2 H2O + 2 I2 + Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
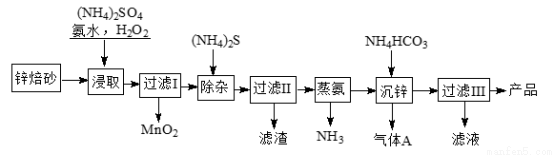
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
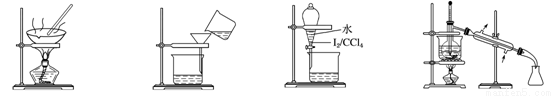
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com