
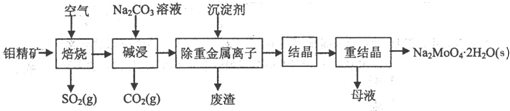

分析 (1)焙烧后生成的三氧化钼与碳酸钠反应生成了MoO42-;
(2)根据钼酸呗和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,在再计算出SO42-的去除率;
(3)使用的次数较多后,母液中杂质的浓度增大,影响产品纯度;
(4)①根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因;
②根据NaNO2具有氧化性的化学性质进行分析;
③根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处,即钼酸钠的浓度150mg•L-1,据此计算出钼酸钠的物质的量浓度.
解答 解:(1)三氧化钼与碳酸钠反应生成了MoO42-,反应的离子方程式为:MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(2)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=$\frac{4.0×1{0}^{-8}}{0.4mol/L}$=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-7}}$mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-$\frac{1.1×1{0}^{-3}}{0.04}$×100%=1-2.75%≈97.3%,
故答案为:97.3%;
(3)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(4)①由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
②NaNO2的具有氧化性,能够在钢铁表面形成FeMoO4-Fe2O3保护膜,
故答案为:替代空气中氧气起氧化剂作用;
③根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:$\frac{150×1{0}^{-3}g}{206g/mol}$≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1,
故答案为:7.28×l0-4mol•L-1.
点评 本题考查了制备钼酸钠晶体的方法,注意分析题中图示是解题关键,最后一问有一定的难度,容易出错,需要合理应用题中数据,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫化钠水解 S2-+2H2O?H2S+2OH- | |
| B. | 硫氢化钠的水解 HS-+H2O?H3O++S2- | |
| C. | 制Fe(OH)3胶体 Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3AlO2-+6H2O═4Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
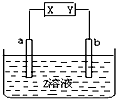 用如图所示电解装置分别完成以下要求,请填空:
用如图所示电解装置分别完成以下要求,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的电子式: | |
| B. | F-的结构示意图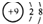 | |
| C. | N2的结构式: | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3- 在水溶液中只电离,不水解 | B. | 硝酸钠溶液水解后呈中性 | ||
| C. | 可溶性的铝盐都能发生水解反应 | D. | 可溶性的钠盐都不发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳碳双键
碳碳双键 3-甲基-2-乙基-1-戊烯④
3-甲基-2-乙基-1-戊烯④ 2-甲基戊烷
2-甲基戊烷 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2-甲基戊烷
2-甲基戊烷 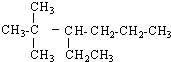
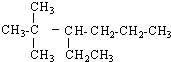 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com