
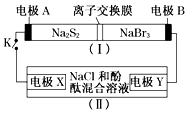
 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )| A. | 装置(Ⅰ)中Na+从左到右通过离子交换膜 | |
| B. | A电极的电极反应式为NaBr3+2Na++2e-═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1 mol Na+通过离子交换膜,X电极上就析出标准状况下的气体1.12 L |
分析 当闭合开关K时,X极附近溶液先变红色,说明X极生成OH-离子,为电解池的阴极,发生反应为2H2O+2e-=H2↑+2OH-,则A为原电池的负极,B为原电池的正极,根据电池充、放电的化学反应方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr可知,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为NaBr3+2Na++2e-=3NaBr,Y极为电解池的阳极,以此解答该题.
解答 解:A.装置(Ⅰ)为原电池,Na+向正极移动,B是正极,因此Na+从右到左通过离子交换膜,故A正确;
B.A为原电池的负极,发生氧化反应,反应为2Na2S2-2e-=2Na++Na2S4,故B错误;
C.X极生成OH-离子,为电解池的阴极,发生还原反应,电极方程式为2H2O+2e-=H2↑+2OH-,故C错误;
D.闭合K时,有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,阴极上生成0.05molH2,标准状况下体积为0.05mol×22.4L/mol=1.12L,故D正确.
故选AD.
点评 本题考查化学电源知识,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意从总反应式判断两极上的变化和电极反应式的书写.


科目:高中化学 来源: 题型:选择题
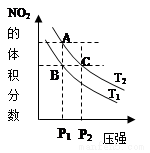 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 若恒温恒容时充入氩气,平衡向逆反应方向移动 | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | 因为B、C两点NO2的体积分数相同,所以化学平衡常数KB=KC. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 只有②③ | C. | 只有③ | D. | 只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )| A. | A、B两种酸溶液物质的量浓度一定相等 | |
| B. | 稀释后A酸溶液的酸性比B酸溶液强 | |
| C. | 稀释后的A、B溶液分别与足量NaOH溶液反应消耗碱的体积相等 | |
| D. | 若A是强酸,则B一定是弱酸,且a=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | 预测的现象 | 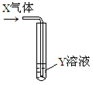 | |
| ① | CO2 | 饱和CaCl2溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NO2 | Na2S溶液 | 白色沉淀析出 |
| A. | 只有①②③ | B. | 只有①② | C. | 只有② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向NH4HCO3溶液中加入足量NaOH溶液共热:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 水电离出的c(H+)=1×10-12mol/L溶液中,可能大量共存的离子:K+、CO32-、Na+、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com