
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
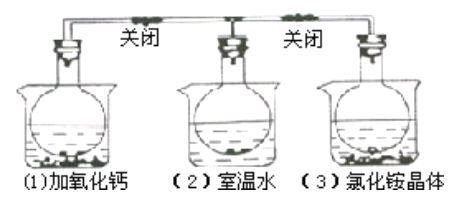
A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合重要的有机化合物路线如下图所示。请回答下列问题。
![]()
(1)A物质所含官能团的名称是____。
(2)反应③的化学方程式是____。
(3)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
Ⅱ.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是____。
(2)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是____。
②实验开始时,试管b中的导管不伸入液面下的原因是____。
(3)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:__. |
②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为____ mol. |
③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
④写出E与NaHCO3溶液反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( )
①两块钠失去电子一样多 ②第一块钠失去电子多 ③第二块钠失去电子多
④两块钠的反应产物质量一样大 ⑤第一块钠的反应产物质量大
⑥第二块钠的反应产物质量大
A. ①④ B. ②⑤ C. ③⑥ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两份等质量的碳酸氢钠晶体,将甲用坩埚充分加热后冷却后,将固体完全转移到一试管中, 再加入足量的盐酸;乙不经加热置于另一试管中,也加入足量的盐酸。反应完全后,两试管中实际参 加反应的HC1质量之比为( )
A. 2:3 B. 2:1 C. 1:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
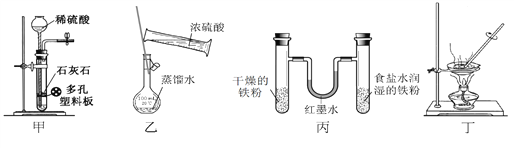
A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用。
(1)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用CoSO4溶液和(NH4)2C2O4溶液反应制得,写出该反应的离子方程式:______________
(2)现将含0.5mol FeCl3的溶液和含1.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++ 3SCN-=Fe(SCN)3(忽略其它过程)。平衡浓度 c[Fe(SCN)3]与温度T的关系如图1所示:则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,则达到平衡时的平均反应速率v(SCN-)=____,该温度下的Fe3+的平衡转化率为____。
(3)工业上用电解浓NaOH溶液制备Na2FeO4,其工作原理如图2所示,则Cu电极连接电源的 ___极,阳极的电极反应式为________________
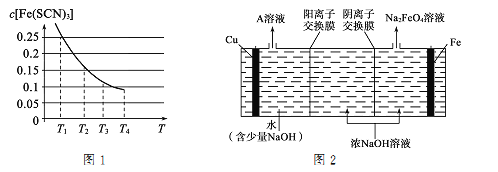
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com