
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2+bCl2+cC aTiCl4+cCO反应(1)
aTiCl4+cCO反应(1)
TiCl4+2Mg Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
下列有关实验原理或实验操作正确的是( )

A.用(a)装置制备并收集少量NO2气体
B.通过(b)装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O
C.装置(c)可用于定量测定H2O2的分解速率
D.装置(d)可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是( )

A.①②③ B.②③④ C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:选择题
下列实验事实所得出的相应结论合理的是( )
实验事实结论
A.Cl2的水溶液可以导电Cl2是电解质
B.将燃着的镁条伸入盛有CO2的集气瓶中继续燃烧还原性:Mg>C
C.SO2可以使酸性KMnO4溶液褪色SO2具有漂白性
D.将铁粉放入稀HNO3中充分反应后,滴入KSCN溶液无明显现象稀HNO3不能将Fe氧化成Fe3+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4??Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C.Na2Cr2O7中Cr元素的化合价为+7
D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:填空题
水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。
请回答下列问题:
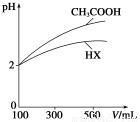
(1)纯水在100 ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的
c(OH-)=________ mol·L-1。
(2)25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为__________,由水电离出的c(OH-)=__________ mol·L-1。
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是__________________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为____________________________。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________
(5)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。
(2)写出X的化学式__________________________,化学名称为_________________。
(3)写出X涉及金属冶炼中的一个化学方程式_______________________________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
________________________________________________________________________。
(5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是_______________________________________
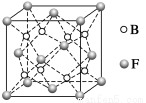
(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:填空题
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示:
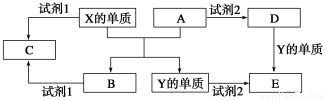
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com