
 H2O
H2O CO2
CO2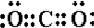 .
. 分析 氮气分子中存在N、N三键,水分子中存在2个H-O键,二氧化碳分子中存在2个C=O键,据此书写电子式即可.
解答 解:氮气分子中,两个氮原子形成了3对共用电子对,氮气的电子式为: ;
;
H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ;
;
CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为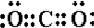 ,故答案为:
,故答案为: ;
; ;
;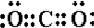 .
.
点评 本题考查电子式的书写,难度不大,注意未成键的孤对电子对容易忽略;掌握电子式的书写:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的同分异构体有两个,分别是CH3OCH3和CH3CH2OH | |
| B. | 分子式为C8H10的芳香烃有3种,分别为 、 、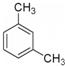 、 、 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷是正四面体结构, 和 和 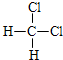 是同一种物质 是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
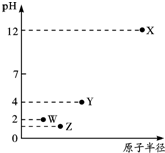
| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②④ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
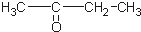 )、丙酮(
)、丙酮(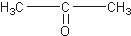 )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )| A. | 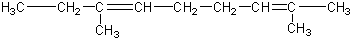 | |
| B. | 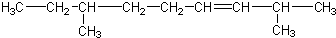 | |
| C. | 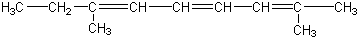 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com