
 ������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȣ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ��
������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȣ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ��| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
| ���� �¶�/�� | ����̿ | NO | E | F |
| ��ʼ | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
���� ��1����PM2.5����������ˮ�����Ƴɴ�����������������г���ˮ�����������⣬��һ����H+��OH-��������Һ�е���غ�����ʽ�������ˮ�����ӻ������㣻��2�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��3������֪����H2��g��+$\frac{1}{2}$O2��g���TH2O��g������H=-241.8kJ•mol-1����C��s��+$\frac{1}{2}$O2��g���TCO��g������H=-110.5kJ•mol-1�����ø�˹���ɣ�����-�ٿɵý�̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��
�ڶ���������һ��������������ԺͼӦ��������������ˮ�������ᣬ����ǿ��̼�ᣬ���Կ��Ժ�̼������Һ��Ӧ��
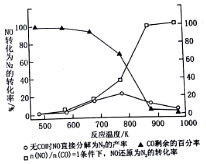
��4�������¶ȣ�����NO�ķֽ��ʽ��ͣ�˵����Ӧ���淴Ӧ������У��÷�Ӧ���ȣ�
��5���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ��3.000-2.960������0.10-0.020����0.040��0.040=1��2��1��1����Ӧ��C��������
�ٽ��ԭ���غ��֪������ΪN2��CO2��
����T1��T2���¶�����NOŨ������ƽ��������У�
�۷�ӦC+2NO?N2+CO2��һ�������������ķ�Ӧ������Ӧ��ֻ��һ�֣��ʼ���NO���壬������ƽ���ԭƽ��Ϊ��Чƽ�⣮
��� �⣺��1���ܽ�PM2.5����������ˮ�����Ƴɴ�����������������г���ˮ�����������⣬��һ����H+��OH-��
������Һ�е���غ��֪��C��K+��+C��NH4+��+c��Na+��+C��H+��=2C��SO42-��+C��NO3-��+C��Cl-��+c��OH-���٣�
����Һ������ˮ�����ӻ�KW=c��H+��•c��OH-��=10-14�ڣ�
�����٢ڿɽ��C��H+��=1��10-4mol•L-1����pHֵΪ4��
�ʴ�Ϊ��4��
��2��N2��g��+O2��g��?2NO��g����H��0���£������ܱ������У�
A����Ӧǰ�������������䣬������䣬���������ܶ�ʼ�ղ��仯������˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ�������������䣬�������ʵ������䣬��������ѹǿʼ�ղ��仯�����Բ���˵����Ӧ�ﵽƽ��״̬����B����
C��N2��O2��NO�����ʵ���֮��Ϊ1��1��2 ����˵�����淴Ӧ������ͬ����C����
D��������ת���ʲ��ٱ仯��˵�����淴Ӧ������ȣ���Ӧ��ƽ��״̬����D��ȷ��
�ʴ�Ϊ��D��
��3������֪����H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1��
���ø�˹���ɣ�����-�ٿɵã�C��s��+H2O��g��=CO��g��+H2��g������H=��-110.5kJ/mol��-��-241.8kJ/mol��=+13l.3 kJ/mol��
���Խ�̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C��s��+H2O��g���TCO��g��+H2��g����H=+13l.3kJ•mol-1��
�ʴ�Ϊ��C��s��+H2O��g���TCO��g��+H2��g����H=+13l.3kJ•mol-1��
��A�������������������������Ծ��������������ͨ���ܹ���Ũ��ˮ��Ӧ��������Ũ��ˮ���ն�������A��ȷ��
B����������ˮ��Һ������������Ҳ�ܹ���̼�����Ʊ�����Һ��Ӧ�����ɶ�����̼���壬������̼��������Һ��ϴ�Ӽ�����B��ȷ��
C�����������Ӧ�����������ᣬ���Ա����������������Զ����������Ȼ���������Ӧ����C����
D�������������Ȼ�����Һ����Ӧ���������Ȼ�����Һ���ն�������D����
��ѡ��AB��
��4�������¶ȣ�����NO�ķֽ��ʽ��ͣ�˵����Ӧ���淴Ӧ������У��÷�Ӧ���ȣ�
��ͼ��֪����$\frac{n��NO��}{n��CO��}$=1�������£�870Kʱ��NO��ԭΪN2��ת���ʽӽ�Ϊ100%��
�ʴ�Ϊ��NO�ķֽⷴӦ�Ƿ��ȷ�Ӧ�����������ڷ�Ӧ������У�870��
��5���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ��3.000-2.960������0.10-0.020����0.040��0.040=1��2��1��1����Ӧ��C��������
�ٽ��ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ����Ӧ����ʽΪC+2NO?N2+CO2��
�ʴ�Ϊ��C+2NO?N2+CO2��
��T1��T2��ͼ����NO���¶���������˵������ƽ��������У�����ӦΪ���ȷ�Ӧ���÷�Ӧ��H��0��
�ʴ�Ϊ������
�۷�ӦC+2NO?N2+CO2��һ�������������ķ�Ӧ������Ӧ��ֻ��һ�֣��ʼ���NO���壬������ƽ���ԭƽ��Ϊ��Чƽ�⣬ԭƽ����NOת����Ϊ $\frac{0.10-0.020}{0.10}$��100%=80%����ﵽ��ƽ��ʱNO��ת����Ϊ80%��
�ʴ�Ϊ��80%��
���� �����ۺϿ��黯ѧ��Ӧԭ���Ļ���֪ʶ���漰����غ㡢pHֵ�ļ��㡢��ѧ��Ӧ����ʽ����д��ת���ʵļ��㣬ƽ����ƶ��ȣ���Ŀ�Ѷ��еȣ�ע�����֪ʶ�Ļ��ۣ�


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��K+��+c��H+���Tc��OH-��+c��HS-��+2 c��S2-�� | B�� | c��K+����c��HS-����c��OH-����c��H+�� | ||
| C�� | c��HS-��+c��S2-��+c��H2S��=0.1 mol•L-1 | D�� | c��K+����c��HS-����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��W��X��Y��Z | |
| B�� | ���⻯����ȶ��ԣ�X��Y��Z | |
| C�� | W�ֱ���X��Z�γɵĻ������������ˮ�ĵ��� | |
| D�� | �ڻ�����A �ķֽⷴӦ�б�Ϊ���������Ϊ��ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
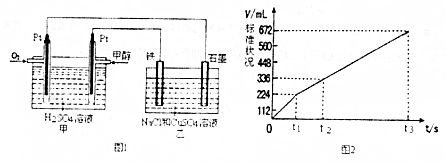
| ���� | A | B |
| ��Ӧ��Ͷ���� | 1molCO2��g����3molH2��g�� | 1molCH3OH��g����1molH2O��g�� |
| ��Ӧ�����仯 | �ų�29.4KJ | ����aKJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
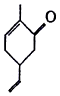
| A�� | ���Է���������Ӧ | B�� | ����ʽΪC9H10O | ||
| C�� | ����������ԭ�Ӷ�����ͬһƽ���� | D�� | ��ʹ������Ȼ�̼��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�� | ���� | ���� |
| A | 25�棬��Ƭ��ͬ��AlƬ�ֱ�͵����ϡHNO3��ŨHNO3��Ӧ | ǰ�߲�����ɫ���壬���߲�������ɫ���壬�Һ��߷�Ӧ���Ӿ��� | ����������ͬʱ����Ӧ��Ũ��Խ��Ӧ����Խ�� |
| B | ����ˮ�Ҵ���ŨH2SO4�Ļ���������170�棬����������ͨ������KMnO4��Һ | KMnO4��Һ�Ϻ�ɫ��ȥ | ��ϩ���л�ԭ�� |
| C | SO2ͨ��BaCl2��Һ��Ȼ�����ϡ���� | �а�ɫ��������������ϡ�����������ܽ� | ���ó���ΪBaSO3����ת��ΪBaSO4 |
| D | ��ʢ��AgCl�����Թ��м���һ������0.01mol•L-1 KI��Һ | �����ɰ�ɫ��Ϊ��ɫ | Ksp��AgCl����Ksp��AgI�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/L��NH4HSO4��Һ��Ba2+��Na+��NO3-��Cl- | |
| B�� | ͨKSCN��Һ���ɫ����Һ��NH4+��Al3+��SO42-��Cl- | |
| C�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��1014����Һ��Ca2+��Na+��ClO-��NO3- | |
| D�� | ������Ӧ����������������Һ��K+��Na+��CO32-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
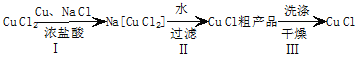
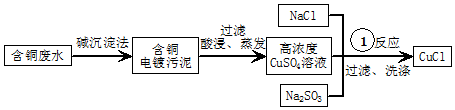
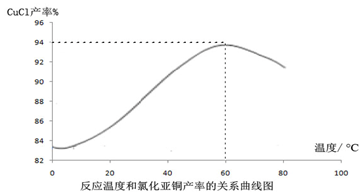
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ���÷�Ӧ�л�ԭ����KI��21.4g KIO3�μӷ�Ӧʱת�Ƶ���0.5mol��
���÷�Ӧ�л�ԭ����KI��21.4g KIO3�μӷ�Ӧʱת�Ƶ���0.5mol���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com