
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
A.CO全部转化为乙醇
B.反应体系中乙醇的物质的量浓度不再变化
C.正反应和逆反应的化学反应速率均为零
D.CO和H2以1:2的物质的量之比反应生成乙醇
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为___________________;10min生成SO3的化学反应速率为___________________。
(2)下列关于该反应的说法正确的是___________________。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
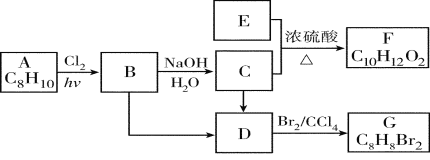
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气与氢气的相对密度为30,则E的分子式为________;
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为:________________;
(3)由B生成D的反应条件是________________;
(4)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________个,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是_________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是___________________。
(4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有__________,请写出工业上用氯气和消石灰生产漂粉精的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌铜原电池池中,如图
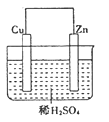
(1)锌为______极,发生的______反应,电极反应式_________________________________,观察到的现象是_______________。
(2)铜为______极,发生的______反应,电极反应式 ______________,观察到的现象是__。
(3)阳离子移向_______________极。
(4)电子从 ______________流向极到 _______________极。
(5)当电路中转移0.2mol电子,消耗硫酸的质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1 mo1.L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图中的K闭合,下列判断正确的是( )

A.去掉盐桥,此装置也能正常工作
B.盐桥中的K+向盛有硫酸铜溶液的烧杯移动,高锰酸根离子向b移动
C.一段时间后,硫酸铜溶液浓度减小
D.C极上的电极反应式为Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物 WX2,Y原子内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A. WX、WX2、ZX2的化学键类型完全相同
B. WZ2分子中所有原子最外层都满足8电子结构
C. 由于X的常见氢化物(H2X)分子间存在氢键,故H2X比H2Z 稳定
D. 原子半径大小顺序为X<W<Z<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com