
分析 Br元素的化合价由+3价升高为+5价,O元素的化合价由-2价升高为0,Br元素的化合价由+3价降低为0,该反应中转移6e-,根据电子守恒,计算解答.
解答 解:(1)Br元素的化合价由+3价升高为+5价,O元素的化合价由-2价升高为0,还有的Br元素的化合价由+3价降低为0,该反应中转移6e-,根据电子守恒,a、b 之间的关系为a+2b=6,故答案为:a+2b=6;
(2)由反应可知,H2O作还原剂被氧化,BrF3作还原剂,根据电子守恒,每生成2molBr2应该生成的是2mol氧气,若有0.3molH2O被氧化,则被水还原的BrF3的物质的量为0.2mol.
故答案为:0.2.
点评 本题考查氧化还原反应计算,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,侧重电子守恒的考查,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN溶液的导电性比盐酸的弱 | B. | 1mol/LNaCN溶液呈碱性 | ||
| C. | NaCN可以与盐酸反应 | D. | 1mol/LHCN溶液的pH约为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
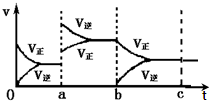 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于-110.5 kJ/mol | |
| B. | ①的反应热为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-114.6 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com