
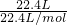 =1mol,由反应①可知,转移电子为2mol,故B正确;
=1mol,由反应①可知,转移电子为2mol,故B正确;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| m-c |
| m |
| m-c |
| m |
查看答案和解析>>
科目:高中化学 来源:浙江省温州中学2011-2012学年高二下学期期末考试化学试题 题型:022
(1)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436 KJ·mol-1,N≡N键能为945KJ·mol-1,N-H键能为391 KJ·mol-1.写出合成氨反应的热化学方程式:________
(2)可逆反应N2+3H2![]() 2NH3在恒容密闭容器中进行,达到平衡状态的标志是________.
2NH3在恒容密闭容器中进行,达到平衡状态的标志是________.
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
③容器中N2、H2、NH3的物质的量为1∶3∶2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2 L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
5 min内,消耗N2的平均反应速率为________;此条件下该反应的化学平衡常数K=________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2 mol,化学平衡将向________(填“正反应”或“逆反应”)方向移动.
(4)氨是氮肥工业的重要原料.某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
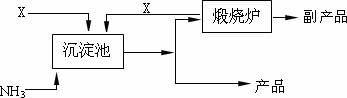
请写出制备(NH4)2SO4的反应方程式:________;并利用有关数据简述上述反应能发生的原因________.
查看答案和解析>>
科目:高中化学 来源:2011届江西省重点中学协作体高三第二次联考(理综)化学部分 题型:填空题
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
 4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“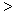 ”、 “
”、 “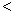 ”或“=”), △H=_____________。
”或“=”), △H=_____________。查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂[来源:Z.xx.k.Com]
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
C(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,消耗N2的平均反应速率为 ;此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 (填“正反应”或“逆反应”)方向移动。
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com