
【题目】下列有关说法正确的是
A. 用新制Cu(OH)2悬浊液检验牙膏中的甘油时,可生成绛蓝色沉淀
B. 用纸层析法分离Cu2+和Fe3+,为了看到色斑,必须通过氨熏
C. 氯化钻浓溶液加水稀释,溶液的颜色由蓝色逐渐转变为粉红色
D. 摘下几根火柴头,浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀硝酸,若出现白色沉淀,说明火柴头中含氯元素
【答案】C
【解析】
A. 用新制Cu(OH)2悬浊液检验牙膏中的甘油时,可生成绛蓝色溶液,A错误;
B. 用纸层析法分离Cu2+和Fe3+,为了看到色斑,Cu2+和Fe3+本身就具有不同颜色,不必须通过氨熏,B错误;
C. 氯化钴浓溶液中,主要存在[CoCl4]2-,为蓝色离子,氯化钴稀溶液,主要存在[Co(H2O)6]2+,为粉红色离子,溶液中存在平衡[CoCl4]2-+6H2O![]() [Co(H2O)6]2++4Cl-,加水稀释平衡向右移动,溶液的颜色由蓝色逐渐转变为粉红色,C正确;
[Co(H2O)6]2++4Cl-,加水稀释平衡向右移动,溶液的颜色由蓝色逐渐转变为粉红色,C正确;
D. 火柴头中含有氯酸钾,硝酸银能和氯离子反应生成不溶于稀硝酸的白色沉淀,所以硝酸酸化的硝酸银能检验氯离子,但硝酸银不和氯酸根离子反应,所以不能检验氯酸根离子,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1molNH3需要放出___kJ的热量。
(2)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(Lmin)。计算:
①前2min内用Y的浓度变化表示的反应速率为___。
②化学方程式中n的值是___。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
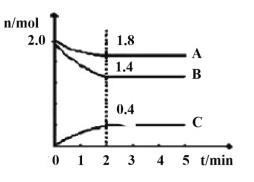
该反应的化学方程式为____。
下列叙述能说明上述反应达到平衡状态的是___。
A.混合气体的平均摩尔质量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.容器内压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
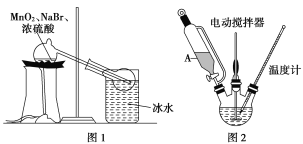
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法不正确的是( )
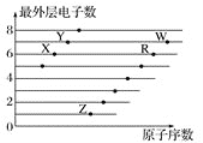
A.氢化物沸点:H2X>H2R
B.含氧酸酸性:HWO>H2RO4
C.气态氢化物的稳定性:HY>HW>H2R
D.离子半径:R2->X2->Y->Z+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 该温度下,BaSO4的Ksp=8×10﹣10 B. M点和P点对应的Ksp相等
C. N点无BaSO4沉淀生成 D. 加入Na2SO4可以使溶液由Q点变到P点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
A.AlN中氮元素的化合价为+3
B.上述反应中,N2是还原剂,Al2O3是氧化剂
C.上述反应中,每生成1molAlN需转移6mol电子
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是( )
A. 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层
B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO
C. 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化
D. Fe3O4胶体粒子能用减压过滤法实现固液分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com