
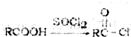
 ,F
,F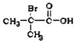 .
.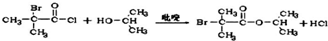 .
. .
. .
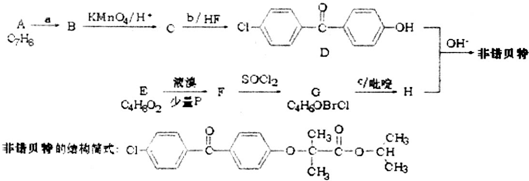
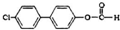
. 分析 由D与非诺贝特的结构简式,可知H为 ,由转化关系及反应信息,可知E为(CH3)2CHCOOH,E与溴发生取代反应生成F为
,由转化关系及反应信息,可知E为(CH3)2CHCOOH,E与溴发生取代反应生成F为 ,F与SO2Cl发生取代反应生成G为
,F与SO2Cl发生取代反应生成G为 ,对比G、H的结构可知c为
,对比G、H的结构可知c为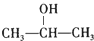 .由D的结构,结合A的分子式可知A为
.由D的结构,结合A的分子式可知A为 ,与氯气发生甲基对位取代反应生成B为
,与氯气发生甲基对位取代反应生成B为 ,B被酸性高锰酸钾溶液氧化生成C为
,B被酸性高锰酸钾溶液氧化生成C为 ,可推知b为
,可推知b为 .
.
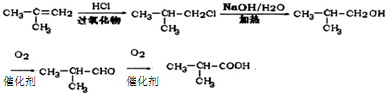
(6)中2-甲基丙烯与HCl发生加成反应得到 ,再发生水解反应得到
,再发生水解反应得到 ,发生催化氧化得到
,发生催化氧化得到 ,再氧化得到E.
,再氧化得到E.
解答 解:由D与非诺贝特的结构简式,可知H为 ,由转化关系及反应信息,可知E为(CH3)2CHCOOH,E与溴发生取代反应生成F为
,由转化关系及反应信息,可知E为(CH3)2CHCOOH,E与溴发生取代反应生成F为 ,F与SO2Cl发生取代反应生成G为
,F与SO2Cl发生取代反应生成G为 ,对比G、H的结构可知c为
,对比G、H的结构可知c为 .由D的结构,结合A的分子式可知A为
.由D的结构,结合A的分子式可知A为 ,与氯气发生甲基对位取代反应生成B为
,与氯气发生甲基对位取代反应生成B为 ,B被酸性高锰酸钾溶液氧化生成C为
,B被酸性高锰酸钾溶液氧化生成C为 ,可推知b为
,可推知b为 .
.
(1)B为 ,名称为4-氯甲苯,故答案为:4-氯甲苯;
,名称为4-氯甲苯,故答案为:4-氯甲苯;
(2)C为 ,所含官能团为:羧基,故答案为:羧基;
,所含官能团为:羧基,故答案为:羧基;
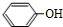
(3)b的结构简式为 ,F的结构简式为:
,F的结构简式为: ,
,
故答案为: ;
; ;
;
(4)G到H的反应方程式: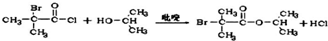 ,
,
故答案为: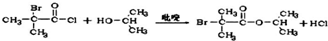 ;
;
(5)同时符合下列条件的D的同分异构体:①能发生银镜反应,说明含有醛基,②含5种不同环境氢的联苯酯类有机物,含有甲酸与酚形成的酯基,该同分异构体结构简式为: ,卤代烃水解得到酚羟基、HCl,可以消耗2mol NaOH,酯基水解得到酚羟基与羧基,可以消耗2mol NaOH,1mol该有机物最多消耗NaOH的物质的量为4mol,
,卤代烃水解得到酚羟基、HCl,可以消耗2mol NaOH,酯基水解得到酚羟基与羧基,可以消耗2mol NaOH,1mol该有机物最多消耗NaOH的物质的量为4mol,
故答案为: ;4mol;
;4mol;
(6)2-甲基丙烯与HCl发生加成反应得到 ,再发生水解反应得到
,再发生水解反应得到 ,发生催化氧化得到
,发生催化氧化得到 ,再氧化得到E,合成路线流程图为:
,再氧化得到E,合成路线流程图为: .
.
点评 本题考查有机物的推断与合成,根据有机物的结构采用正、逆推法相结合的方法分析,需要学生对给予的信息进行利用,熟练掌握官能团的性质与转化,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作水果的催熟剂 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2的溶液中:H+、Mg2+、Br-、NO3- | |
| B. | 含有大量HCO3-的溶液:NH4+、Ca2+、AlO2-、I- | |
| C. | 浓度为3%的H2O2溶液:H+、Fe2+、C1-、SO42- | |
| D. | c(S2-)=0.1mo1.L-1的溶液中:Na+、NH4+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
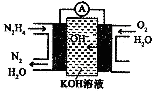 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
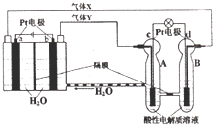
| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com