
| A. | 1mol苯乙烯(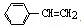 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
科目:高中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
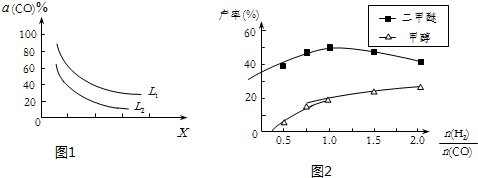
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾充分加热后的剩余固体、碘酒、空气都是混合物 | |
| B. | Na2O和NH3的水溶液均能导电,故均为电解质 | |
| C. | 氧化还原反应中非金属单质只作氧化剂 | |
| D. | 酸碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应都可用H++OH-═H2O表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com