
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
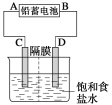
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
【答案】2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 负 1 22.4 a /2mol·L1
2NaOH+Cl2↑+H2↑ 负 1 22.4 a /2mol·L1
【解析】
本题考查的是电解原理知识。
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明氢离子在D极放电,产生了大量的氢氧根离子,使D极溶液显碱性,则D极为电解池的阴极,阴极与电源负极相连,则B极为电源的负极。
(3)①依据电解氯化钠生成氯气的电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子的物质的量,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质的物质的量浓度。
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。本小题答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑。本小题答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明氢离子在D极放电,产生了大量的氢氧根离子,使D极溶液显碱性,则D极为电解池的阴极,阴极与电源负极相连,则B极为电源的负极。本小题答案为:负。
(3)①电解氯化钠生成氯气的电极反应为2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为0.5mol,转移电子物质的量为1mol。本小题答案为;1。
②蓄电池消耗H2SO42mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸转移电子2mol,根据电子守恒,电解食盐水阴极电极反应2H++2e-=H2↑,转移电子也为2mol,则生成氢气1mol,标准状况体积为22.4L。本小题答案为:22.4L。
③依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸转移电子amol,根据电子守恒,则2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑反应中转移电子也为amol,则生成氢氧化钠物质的量为amol,氢氧化钠的浓度为amol/2L=
2NaOH+Cl2↑+H2↑反应中转移电子也为amol,则生成氢氧化钠物质的量为amol,氢氧化钠的浓度为amol/2L= ![]() mol/L。本小题答案为:
mol/L。本小题答案为:![]() mol/L。
mol/L。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如图,请根据要求填空:

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③__________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应_________。
=x,若理论上欲获得最多的氯化氢,则x值应_________。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2![]() 2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是____________。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是___________。
(5)E装置的作用是____________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为_____________;该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____ (填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
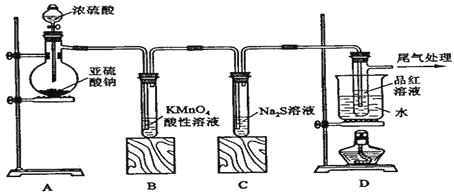
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.2CH3CH2OH+O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,电流表G发生偏转,a极逐渐变粗,同时b极逐渐变细,c为电解质溶液,则a、b、c可能是下列各组中的( )

A.a是Ag、b是Fe、c为AgNO3溶液B.a是Ag、b是Cu、c为Cu(NO3)2溶液
C.a是Zn、b是Cu、c为稀H2SO4D.a是Cu、b是Zn、c为稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )

选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com