
【题目】现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是热反应,且a+bp(填“>”“<”或“=”).
(2)减压时,A的质量分数(填“增大”“减小”或“不变”,下同),正反应速率 .
(3)若加入B(体积不变),则A的转化率 , B的转化率 .
(4)若升高温度,则平衡时,B、C的浓度之比 ![]() 将
将
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色 , 而维持容器内气体的压强不变,充入氖气时,混合物的颜色 . (填“变浅”“变深”或“不变”)
【答案】
(1)放;>
(2)增大;减小
(3)增大;减小
(4)减小
(5)不变
(6)变深;变浅
【解析】解:(1)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,逆反应为放热反应,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,所以答案是:放;>;(2)减压平衡向逆反应方向移动,则A的质量分数增大,正反应反应速率减小,
所以答案是:增大;减小;(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,B加入的多,而转化的少,则B的转化率反而减小,
所以答案是:增大;减小;(4)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的比值将减小,
所以答案是:减小;(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,
所以答案是:不变;(6)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅,
所以答案是:变深;变浅.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列有关实验装置进行的相应实验,不能达到实验目的的是

图1 图2 图3 图4
A. 用图1所示装置吸收多余的Cl2
B. 用图2所示装置蒸发NaCl饱和溶液制备NaCl晶体
C. 用图3所示装置制取少量纯净的CO2
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①C (s)+ ![]() O2(g)═CO (g)△H=﹣110.5kJmol ﹣1
O2(g)═CO (g)△H=﹣110.5kJmol ﹣1
②C (s)+O2 (g)═CO2 (g)△H=﹣393.51kJmol ﹣1
则反应:C (s)+CO2(g)═2CO (g) 的△H为( )
A.﹣283.01 kJmol ﹣1
B.+504.00 kJmol ﹣1
C.+283.01 kJmol ﹣1
D.+172.51 kJmol ﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( ) 
A.30~40 min 间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min 时降低温度,40 min 时升高温度
D.30 min时减小压强,40 min时升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C,D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2N2O4△H=﹣57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时: 
(1)C中的气体颜色;D中的气体颜色 .
(2)25℃时,2NO2N2O4达到平衡时,c(NO2)=0.012 5mol/L,c(N2O4)=0.032 1mol/L,则NO2的起始浓度为 , NO2的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题.
(1)A元素的负一价离子的电子层结构与氩相同,它在元素周期表中的位置为
(2)B元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素名称为
(3)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D的最外层电子排布式为
(4)X元素的原子最外层电子排布式为nsnnpn+1 , Y元素的某同位素原子无中子.X和Y形成的最简单化合物的结构式为
(5)M元素的正三价离子的3d能级为半充满,M基态原子的电子排布式为
(6)如表是N逐级失去电子的电离能.
I1 | I2 | I3 | I4 | I5 | I6 | |
In | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
则元素N的常见价态是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:K+、AlO2﹣、NO3﹣、CO32﹣
B.c(ClO﹣)=1.0 mol?L﹣1溶液:Na+、SO32﹣、S2﹣、Cl﹣
C.水电离出来的c(H+)=1×10﹣12的溶液:K+、NH4+、SO42﹣、Fe3+
D.![]() =0.1 mol?L﹣1的溶液:Na+、AlO2﹣、CO32﹣、NO3﹣
=0.1 mol?L﹣1的溶液:Na+、AlO2﹣、CO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象.①甲同学设计实验的目的是;
②反应最剧烈的烧杯是(填字母);
③写出b烧杯里发生反应的离子方程式 .
(2)乙同学设计实验验证:元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如下图装置验证C、N、Si三种元素的非金属性强弱.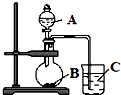
①写出所选用物质的化学式:A; B;C;
②写出圆底烧瓶中发生反应的离子方程式;
③写出烧杯中发生反应的离子方程式;
④碳、氮、硅三种元素的非金属性由强到弱顺序为;
(3)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该置中应盛放(填试剂).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com