
确定某溶液中含有SO42-,下列方案中正确的是
A.先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解
B.先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀
C.先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀
D.先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀
科目:高中化学 来源: 题型:填空题
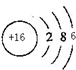
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.| X | |||
| Z | W | Y |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
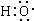
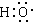 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

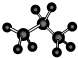
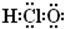
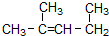 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚和乙酸都能与NaOH溶液反应 | |
| B. | 甲酸可发生银镜反应,而乙酸不能 | |
| C. | 苯酚能与氢氧化钠溶液反应 而乙醇不行 | |
| D. | 乙烯可发生加成反应,而乙烷不能 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列关于实验基本操作的叙述,不正确的是
A. 用蒸发皿进行加热蒸发时,不需要垫加石棉网即可直接进行加热
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生局部过热而暴沸
C. 蒸馏时,冷凝水应从冷凝管上口进,下口出
D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1 )一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
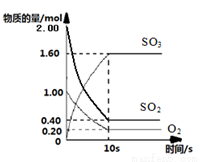
①反应的化学方程式为
②反应开始到10s,用SO2表示的反应速率为
③O2的平衡转化率为
(2)对于反应:2SO2(g)+O2(g) 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(3)已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com