
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeSO4 |
分析 Fe元素质量分数$\frac{Fe原子相对原子质量×原子个数}{相对分子质量}×100%$,将不同化学式转化为只含一个Fe原子的式子,分子相同,如果相对分子质量越小,则Fe元素含量越高.
解答 解:Fe元素质量分数$\frac{Fe原子相对原子质量×原子个数}{相对分子质量}×100%$,将不同化学式转化为只含一个Fe原子的式子,分子相同,如果相对分子质量越小,则Fe元素含量越高,Fe2O3、Fe3O4的化学式改写为$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$,根据FeO、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeSO4知,Fe原子个数相等,相对分子质量大小顺序是FeSO4、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeO,则铁含量从小到大顺序是FeSO4、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeO,故选A.
点评 本题考查元素质量分数计算,为高频考点,明确质量分数含义是解本题关键,注意化学式的灵活改变,从而正确解答,题目难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
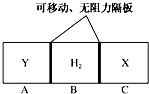 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )| A. | X、Y均为气体单质 | |
| B. | X、Y的相对分子质量相等 | |
| C. | n(H2)<n(X)=n(Y) | |
| D. | 隔板停止滑动时,A、B、C三部分体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
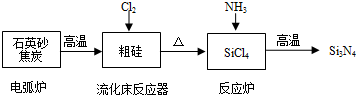
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=1:2 | |
| D. | 从6到9,相应离子反应式H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com