
【题目】25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,则下列说法正确的是( )
A.该溶液的pH一定是9B.该溶液的pH可能为5
C.该溶液的pH可能是7D.不会有这样的溶液
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的质子数是Y的2倍,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是

A.五种元素中原子半径最大的是X,离子半径最大的是Q离子
B.五种元素中Q的最高价氧化物所对应的水化物的酸性最强
C.Y与Z形成的化合物一定是碱性氧化物
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为__________________。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7,离子浓度大小关系_______。
(3)pH=2的CH3COOH与pH=12的NaOH等体积混合,离子浓度大小关系______。
(4)将标准状况下2.24LCO2缓慢通入1L0.15mol·L-1的NaOH溶液中,气体被充分吸收,离子浓度大小关系________。
(5)通过 本题的解答,总结若要比较溶液中离子浓度大小顺序,应先确定_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
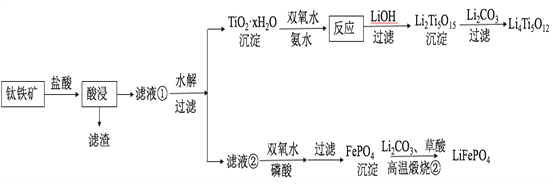
回答下列问题:
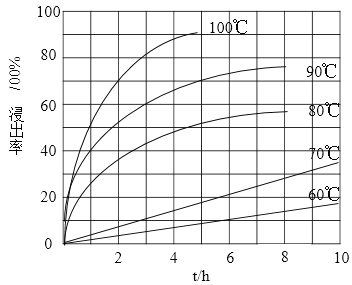
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是

A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B![]() 2C
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
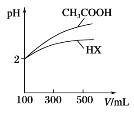
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-丁烯是一种重要的有机化工原料。回答下列问题:
(1)已知2-丁烯有顺、反两种同分异构体,可表示为顺![]() 、反
、反![]() 。一定条件下,它们分别发生加成反应的热化学方程式为:
。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺![]() :
:
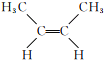
![]() 。
。
②反![]() :
:
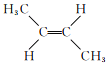
![]()
相同条件下,两种气体之间存在如下转化:
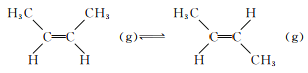
该反应的△H=________。下列叙述中,能表明该反应已达到平衡状态的是________(填序号)。
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是___________________________。
(2)2-丁烯与氯气反应时,一般用镍作催化剂。镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g) ![]() Ni(CO)4(g) △H<0
Ni(CO)4(g) △H<0
Ⅱ.Ni(CO)4(g) ![]() Ni(s)+4CO(g)
Ni(s)+4CO(g)
则下图中能反映出羰基法提纯粗镍过程中能量变化的是________。

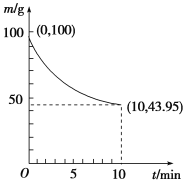
②一定条件下,在2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为________mol/(L·min)。
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时________(填序号)。
a.平衡常数K增大 b.CO的浓度减小 c.v逆[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍:将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。

①下列条件可以判定反应到达平衡状态的是____(填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。

①α(CO)随温度升高而减小的原因是____。
②图中压强p1、p2、p3中最大的是____。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com