
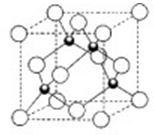
科目:高中化学 来源:不详 题型:计算题
 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2和O3互为同位素 | B.O2转化为O3为化学变化 |
| C.相同物质的量的O2和O3的体积相同 | D.相同质量的O2和O3含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H-F的键能大于H-Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1个甘氨酸分子中存在10对共用电子 |
| B.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C.维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
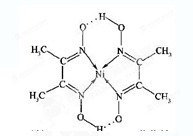
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
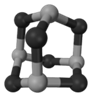
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。 _________________________。
_________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com