
(5分)一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物A
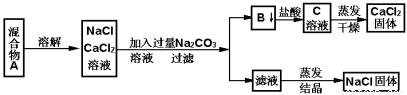
填空和回答下列问题
(1)物质B的电离方程式为 。
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,48 g O2和48 g O3 含有的氧原子数均为3NA
B.1 molL1 NaCl溶液中含有Na+的个数为NA
C.22.4L N2所含分子数为NA
D.标准状况下,22.4 L的SO3中含有NA个SO3分子
查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:填空题
(17分)针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。

a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)。
H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1 ①
P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为______________________________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_______(填“高”或“低”)。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:I.此条件下反应A中,4molHCl被氧化,放出115.6 kJ的热量。
Ⅱ.①写出此条件下,反应A的热化学方程式____________。
②断开1molH-O键与断开1molH-Cl键所需能量相差约为 kJ,H2O中H-O键比HCl中HCl键(填“强”或“弱”) 。

查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.所有的化学反应都有能量变化
B.只要有能量的变化,一定发生了化学反应
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
C.除氦以外的稀有气体原子的最外层电子数都是8
D.同周期元素中VIIA族元素的原子半径较小
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是

A.NO2是该过程的催化剂
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下表各选项中,通过置换反应不能实现由Y到W转化的一组化合物是
A. | B. | C. | D. | |
Y | Na2CO3 | SiO2 | Fe2O3 | H2O |
W | NaHCO3 | CO | Al2O3 | NaOH |
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:填空题
(10分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)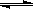 C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
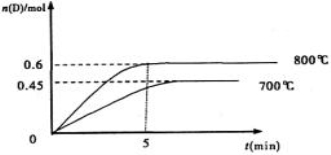
试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________。
(2)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热)。
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是

A.镍是阳极,电极反应4OH--4e-=2H2O+O2↑
B.电解时电流方向:负极→镍电极→溶液→铁电极→正极
C.若隔膜是阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低,阴极区pH升高,撤去隔膜后与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com