
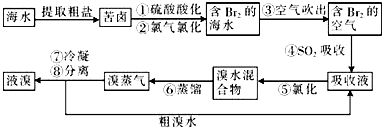
| 1 |
| 3 |
| 10×103L×0.8g/L×(1-25%)×(1-10%) |
| 160g/mol |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、加入铝粉能产生氢气的溶液:K+、Fe2+、SO42-、NO3- |
| C、c(H+)=1×10-13 mol?L-1溶液中:CH3COO-、K+、SO42-、Br- |
| D、存在较多的S2-、SO42-、OH-的溶液中:Mg2+、Cu2+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用铁矿石冶炼铁 |
| B、用Na2SiO3溶液制取硅胶干燥剂 |
| C、对FeCl2溶液与NaOH溶液反应后的沉淀进行过滤 |
| D、夏天食物变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| B、向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
| D、25℃时,pH=9.4、浓度相同的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时,氧化石墨烯作正极 |
| B、放电时,负极电极反应式为Li-e-═Li+ |
| C、充电时,该电池是将电能转化为化学能 |
| D、充电时,电解质溶液中的Li+从阴极迁移到阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
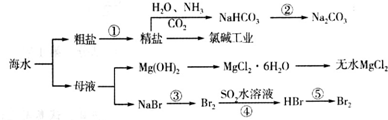
| A、要实现反应②可向NaHCO3溶液中加入过量石灰水 |
| B、溴元素在反应③、⑤中被氧化,在反应④中被还原 |
| C、工业上一般用金属钠与无水MgCl2反应制取Mg单质 |
| D、海水中含有碘元素,可将海水浓缩加热得到碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、0℃、1个标准大气压下,22.4 L NO 和22.4 L O2混合后,所得气体中的分子总数为1.5NA |
| C、1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、只有①② |
| C、只有②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后,可得到NH3的分子数为NA |
| B、常温常压下,18 g H2O中含有的电子总数为8NA |
| C、足量的Cu与Cl2反应生成0.2 mol产物时,失去的电子数为0.4NA |
| D、标准状况下,22.4 L己烯中含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com