
| A. | CO2+2OH-=CO32-+H2O | B. | Al2O3+2OH-=2 AlO2-+H2O | ||
| C. | 2 Al+2OH-+2H2O=2 AlO2-+3H2↑ | D. | Al3++4 OH-=AlO2-+2H2O |
分析 向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-=CO32-+H2O,表现为铝罐变瘪;接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,则罐壁又重新凸起;因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-=2AlO2-+H2O,据此进行解答.
解答 解:向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-=CO32-+H2O,表现为铝罐变瘪;
接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,则罐壁又重新凸起;
因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-=2AlO2-+H2O,
根据以上分析可知,能够发生反应为A、B、C,没有发生的反应为D,
故选D.
点评 本题考查了铝及其化合物性质,题目难度不大,明确发生反应原理为解答关键,注意掌握铝及其化合物性质,试题培养了学生的分析、理解能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | Ag+、Ca2+、CO${\;}_{3}^{2-}$ | B. | SO${\;}_{4}^{2-}$、K+、Na+ | ||
| C. | Fe3+、NO${\;}_{3}^{-}$、Cl- | D. | Cl-、Na+、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
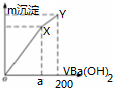
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
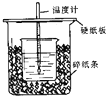 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
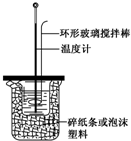
| A. | 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mL 0.50 mol•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应 | |
| D. | 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2O 的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.6mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com