
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.3molO2、0.3molN2和0.4molCO2组成的混合气体,在标准状况下的体积约为22.4L | |
| D. | 标准状况下,1molCO和1molCO2的体积比为1:2 |
分析 A.温度、压强会影响气体摩尔体积;
B.非标准状况下,气体摩尔体积也可能为22.4L/mol;
C.标况下气体摩尔体积为22.4L/mol,适用于单一气体或混合气体,根据V=nVm计算;
D.相同条件下,气体的体积之比等于物质的量之比.
解答 解:A.温度、压强会影响气体摩尔体积,气体摩尔体积不一定都是22.4L/mol,则22.4L任何气体的物质的量不一定为1mol,故A错误;
B.温度、压强会影响气体摩尔体积,非标准状况下,气体摩尔体积也可能为22.4L/mol,1mol气体可能占有22.4L体积,故B错误;
C.标况下气体摩尔体积为22.4L/mol,适用于单一气体或混合气体,而混合气体总共为1mol,则在标准状况下的体积约为22.4L,故C正确;
D.相同条件下,气体的体积之比等于物质的量之比,则1molCO和1molCO2的体积比为1:1,故D错误,
故选:C.
点评 本题考查阿伏伽德罗定律应用,难度不大,注意根据PV=nRT理解温度、压强对气体摩尔体积的影响.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
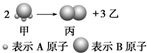 如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,
如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,质软,熔点相对较低,密度比水小 | |
| B. | 大量的钠着火时可以用沙扑灭,不能用水或泡沫灭火剂灭火 | |
| C. | 金属钠在空气中长期放置,最终变为碳酸钠 | |
| D. | Na2O和Na2O2都能由金属钠和氧气化合生成,Na2O和Na2O2氧的价态也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
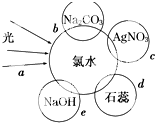 氯气是一种重要的化工原料.
氯气是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲烷中的氢原子被氯原子完全取代,需要2NACl | |
| B. | 1mol•L-1Mg(NO3)溶液中含有NO3-的数目为2NA | |
| C. | 标准状况下.22.4LBr2中所含的分子数为NA | |
| D. | Na2O2与水反应时,每生成0.1 molO2,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com