
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
分析 配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,[TiCl(H2O)5]Cl2•H2O,配体Cl、H2O,提供孤电子对;中心离子是Ti3+,配合物中配位离子Cl-不与Ag+反应,外界离子Cl-离子与Ag+反应,据此分析解答.
解答 解:A.配合物[TiCl(H2O)5]Cl2•H2O,配位体是Cl和H2O,配位数是6,故A错误;
B.中心离子是Ti3+,内配离子是Cl-,外配离子是Cl-,故B错误;
C.配合物[TiCl(H2O)5]Cl2•H2O,内配离子是Cl-为1,外配离子是Cl-为2,内界和外界中的Cl-的数目比是1:2,故C正确;
D.加入足量AgNO3溶液,外界离子Cl-离子与Ag+反应,内配位离子Cl-不与Ag+反应,故D错误;
故选C.
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,题目难度中等.


科目:高中化学 来源: 题型:填空题
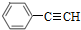 的合成方法有:
的合成方法有: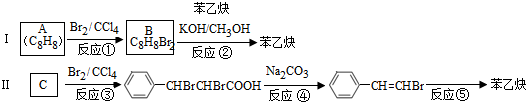

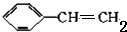 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.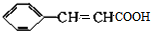 ,反应⑤的化学方程式为
,反应⑤的化学方程式为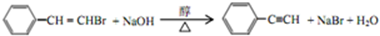 (注明反应条件)
(注明反应条件)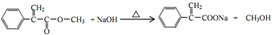 .
.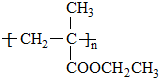 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.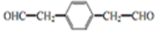 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
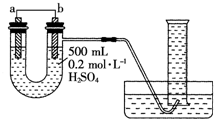 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌做负极 | B. | 放电时,正极产物是银 | ||
| C. | 电解质溶液不可能呈酸性 | D. | 充电时发生了原电池反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 硝酸 | C. | 醋酸 | D. | 高氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
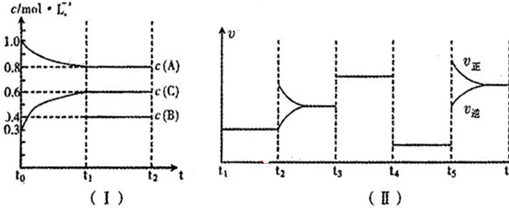
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化、石油的裂化和油脂的皂化都属于化学变化 | |
| B. | 糖、油脂和蛋白质都是人体生命活动所需的基本营养物质 | |
| C. | 静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 | |
| D. | 硝酸纤维、聚酯纤维和光导纤维都可由纤维素在一定条件下制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com