
【题目】用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O = AlO2-+4NH4++2H2O
B. 二氧化锰和浓盐酸共热:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
C. 漂白粉溶液中通入二氧化碳:Ca(ClO)2+H2O+ CO2==CaCO3+2HClO
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2 = 2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 | 物质(微粒) | 电离度α |
A | 硫酸溶液(第一步完全电离):第二步HSO4- | 10% |
B | 硫酸氢钠溶液:HSO4- | 29% |
C | 醋酸:CH3COOH | 1.33% |
D | 盐酸:HCl=H++Cl- | 100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从小到大的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数K与电离度α的关系式为:K= (用含α的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
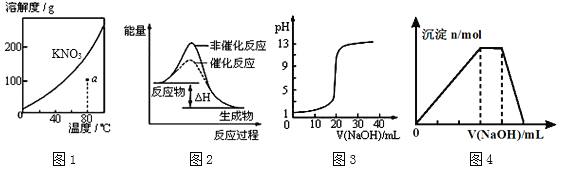
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )
A.稀硫酸与锌粒反应生成气体
B.浓硫酸使铁、铝钝化
C.浓硫酸与铜反应加热反应产生SO2
D.浓硫酸和木炭在加热条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中每种物质都既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4
B.Ba(OH)2、Na2SO4、Na3PO4
C.Na2CO3、HNO3、MgO
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式 。
(2)在一绝热恒容的容器中充入2mol CO和1mol NO2发生上述反应II,以下能说明反应达到平衡状态的是 ( )
A.容器内的总压强不在变化 B.容器内CO和NO2物质的量比不变
C.容器内气体平均密度不变 D.容器内气体温度恒定不变
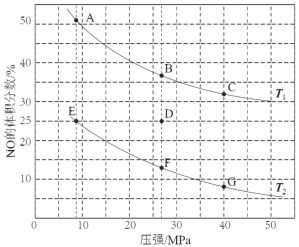
(3)在密闭容器中充入5 mol CO和4 mol NO发生上述反应I,下图为平衡时NO的体积分数与温度、压强的关系。
回答下列问题:
①温度:T1 T2(填“<”或“>” )。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)= 。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点
(4)某温度时,亚硝酸银AgNO2的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)= mol·L-1。
(5)如右图,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式 。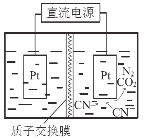
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com