
分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据化学反应速率v=$\frac{△c}{△t}$进行计算;
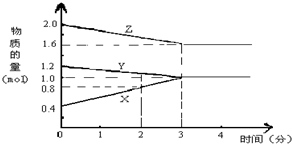
(3)由图可知,反应开始反应混合物Y、Z、X物质的量分别为1.2mol、2.0mol、0.4mol,所以反应从正逆反应同时开始;
(4)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变,据此进行判断.
解答 解:(1)由图象可以看出,反应中Z、Y的物质的量减少,应为反应物,X的物质的量增多,应为生成物,
当反应进行到3min时,△n(Y)=0.8mol-0.6mol=0.2mol,△n(Z)=1.6mol-1.2mol=0.4mol,△n(X)=0.6mol,
则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则该反应的化学方程式为:Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(3))由图可知,反应开始反应混合物Y、Z、X物质的量分别为1.2mol、2.0mol、0.4mol,所以反应从正逆反应同时开始,
故答案为:C;
(4)A.反应Y+2Z?3X是一个气体体积不变的反应,容器内压强始终不变,容器内压强不再发生变化,不能说明反应达到平衡状态,故A错误;
B.X的体积分数不再发生变化,说明各物质的物质的量不变,正反应速率等于逆反应速率,反应已经达到平衡状态,故B正确;
C.正反应速率等于逆反应速率,但是不为0,故C错误;
D.相同时间内消耗3nmolX的同时生成nmolY,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故C错误;
E.反应Y+2Z?3X是一个气体质量、物质的量不变的反应,体系内气体平均相对分子质量始终不发生变化,顾D错误.
故答案为:B.
点评 本题以图象为载体考查化学反应速率、化学平衡的建立、读图提取信息能力,难度不大,结合图的信息运用知识解决问题.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:实验题
 (Ⅰ)和
(Ⅰ)和 (Ⅱ)
(Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | 只有②③⑤ | C. | 只有③④⑥ | D. | 只有①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 溶液. | 说法A不正确 |
| 序号 | 实验步骤 | 现象 | 结论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com