
【题目】下列3种物质:①苯、②乙醇、③乙酸中,常用于皮肤消毒的是_______(填序号,下同);可用来萃取碘水中的碘的是_______;可与NaHCO3溶液反应产生气体的是_______。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解产物,某学生设计了如下实验方案:

回答下列问题:
(1)试剂1是 ,作用是 ;
(2)试剂2是 ,作用是 ,发生的离子反应为: ;如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的 ,若不能,其原因是 。
(3)如何检验第①步实验已基本完成 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出NaHCO3的电离方程式 。
(2)下列物质中:①固体烧碱 ②HCl气体 ③NH3 ④蔗糖 ⑤石墨 ⑥稀硫酸 ⑦熔融KCl ⑧碳酸钙 ⑨Na2O固体;属于非电解质的是 ,能导电的是 。(填编号)
(3)写出仪器名称 ① ② ;仪器①~④中,使用时必须检查是否漏水的 (填序号)。
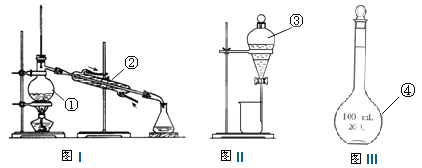
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2;②Cl2;③CH4;④HCl;⑤NH3;⑥NO;⑦NO2;⑧SO2,下列操作正确的是
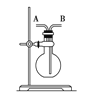
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
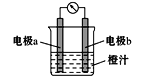
A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中a极为铝条、b极为锌片时,导线中会产生电流
D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:
工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 ,生成5molClO2转移电子 mol。
方法二:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
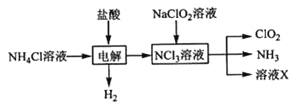
NCl3溶液和NaClO2溶液发生反应的离子方程式 。
X中大量存在的阴离子有_____ 。
(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
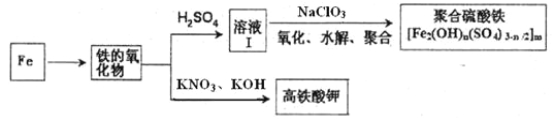
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式: 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
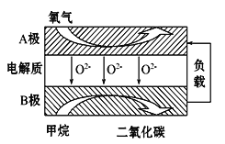
(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下.10mL0.40mol/LH2O2发生催化分解.不同时刻测定生成O2的休积(己折算为标准状况)如下表。
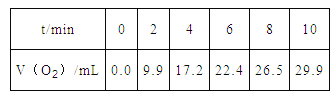
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(Lmin)
C.反应至6min时,c(H2O2) = 0.30mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com