
(20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH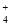 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH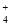 )。
)。
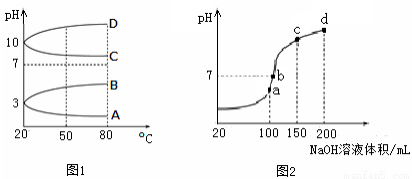
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO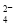 )-c(NH
)-c(NH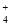 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
(20分)
Ⅰ、(1)2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O (2分) 0.3 (2分)
(2)Zn + 2OH- - 2e- = Zn(OH)2 (2分) 减小(2分)
Ⅱ、(1) 小于 (2分) (2)①A (2分) ②10-3-10-11 (2分)
(3)a (2分) c(Na+)>c(SO )>c(NH
)>c(NH )>c(OH-)=c(H+) (2分)
)>c(OH-)=c(H+) (2分)
(4)能 (2分)
【解析】
试题分析:Ⅰ、(1)KClO在KOH存在条件下,把Fe(OH)3氧化为K2FeO4,同时生成KCl、H2O,根据化合价升降法配平可得化学方程式:2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O;根据Fe元素化合价变化可得:K2FeO4 ~ 3e?,所以生成0.1molK2FeO4转移的电子的物质的量为0.3mol。
(2)放电时电池的负极发生氧化反应,元素化合价升高,根据总方程式可得放电时电池的负极反应式为:Zn + 2OH- - 2e- = Zn(OH)2,根据化学方程式,充电时消耗KOH,所以充电时电解液的pH减小。
Ⅱ、(1) NH4HSO4为强酸的酸式盐,电离出的H+抑制NH4+的水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )小于 0.1 mol·L-1NH4HSO4中c(NH
)小于 0.1 mol·L-1NH4HSO4中c(NH )。
)。
(2)①NH4Al(SO4)2中NH4+和Al3+水解使溶液显酸性,温度升高,水解程度增大,pH减小,故符合0随温度变化的曲线为A。
②根据示意图可知:20℃时,0.1 mol·L-1NH4Al(SO4)2pH为3,则c(H+)=10-3mol?L?1,c(OH?)= 10-11mol?L?1,根据电荷守恒可得:c(H+)+c(NH4+)+3c(Al3+)=c(OH?)+2c(SO42?),所以2c(SO )-c(NH
)-c(NH )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
)-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
(3)a点显酸性,NH4+、Al3+水解,促进了H2O的电离,b点为中性,没有其它离子干扰,c、d显碱性,NaOH过量,抑制了H2O的电离,所以水的电离程度最大的是a;b点为中性,c(H+)=c(OH?),根据电荷守恒,c(Na+)+c(NH4+)=2c(SO42?),溶液显中性,NaOH应稍过量,抵消NH4+水解产生的H+,所以离子浓度由大到小顺序为:c(Na+)>c(SO )>c(NH
)>c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
(4)溶液的pH=5,则c(OH?)=10-9mol?L?1,带入c(Al3+)?c3(OH?)= 2.0×10-33,解得c(Al3+)= 2.0×10-6mol?L?1,所以Al3+完全沉淀。
考点:本题考查氧化还原反应、电化学原理、盐类的水解、离子浓度比较、Ksp的应用。


科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组中属于同位素的是( )。
A.40K与40Ca
B.35Cl2和37Cl2
C.D与T
D.金刚石与石墨
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关金属及其化合物的说法错误的是
A.铁与水蒸气在高温条件下反应生成四氧化三铁和氢气
B.稀硫酸中加入铜粉不反应,再加入硝酸钠仍不反应
C.AlCl3、FeCl2、CuCl2均可通过化合反应制得
D.饱和碳酸钠溶液中通人足量二氧化碳,溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图。下列有关说法中正确的是
A.维生素C的分子式为C6H10O6
B.维生素C的酸性可能是③、④两个羟基引起的
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C由于含有酯基而难溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
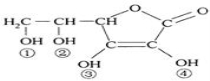
下列物质的类别与所含官能团都正确的是
A. 酚类 –OH B.
酚类 –OH B. 羧酸 –CHO
羧酸 –CHO
C.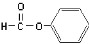 醛类 –CHO D.CH3-O-CH3 醚类
醛类 –CHO D.CH3-O-CH3 醚类 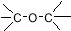
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CH3CH2CH2CH3的二氯取代产物只有5种结构
B.油脂的种类很多,但它们水解后都有一相同产物
C.乙烯、苯、纤维素均属于烃类化合物
D.苯和乙烯都能使溴水层褪色,均与溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第二次教学质量检测理科综合化学试卷(解析版) 题型:选择题
常温下,0.1mol/L的氨水pH=11,下列叙述错误的是
A.向该溶液中加水稀释:c(OH—)/c(NH3·H2O )增大
B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42—)+c(OH—)
C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液中:c(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—)
D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则
c(NH3·H2O)>c(Cl—)>c(NH+)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构(如图)。已知晶体中N — N键的键能为160kJ·mol-1 ,而N ≡ N的键能为942kJ·mol-1 。 则下列有关说法正确的是 ( )
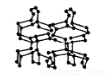
A、高聚氮与氮气互为同位素
B、14g高聚氮含3.01×1023个氮原子
C、高聚氮中氮原子间的化学键为非极性键
D、高聚氮转变成氮气是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
工业上可利用甲烷除去NO气体,反应为CH4(g)+4NO(g)  CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.单位时间内消耗CH4和N2的物质的量比为1∶2时,反应达到平衡
C.平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com