
(1)写出A、C、D的化学式:A______________,C______________,D_________________。
(2)白色沉淀在空气中变化的现象是:________,其化学方程式为___________________。
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
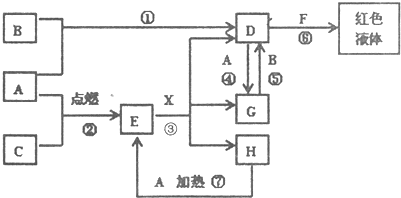
 (2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
(2012?石景山区一模)A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X、Y均为化合物,其中X是一种无氧强酸、E为黑色晶体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
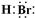

| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
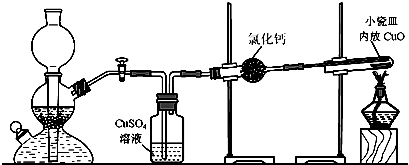
为了验证“铁丝可以在纯净的氧气中燃烧”及“燃烧产物有中Fe2+、Fe3+的存在”。同学们将一根火柴棒塞入一段螺旋状普通细铁丝末端固定;用镊子将铁丝夹住,然后将火柴在酒精灯上点燃,将铁丝由集气瓶口向下慢慢深入,观察现象:
(1)甲同学只发现铁丝红热一下,然后没有现象了。请你分析铁丝没有燃烧的可能原因 (填序号):
A.氧气不纯(或没收集满)
B.火柴太长消耗了氧气
C.铁丝表面有氧化物(或铁锈)
D.没有预热末端铁丝,温度没有达到铁丝的着火点
(2)乙同学做了一些准备工作,当铁丝在纯净氧气中燃烧时,火星四射,并有黑色固体生成。现有实验用品:细纯铁铁丝、细含碳铁丝、镁条、细铜丝、集气瓶装的几瓶纯氧、火柴、酒精灯、镊子、砂纸等。请回答:
①你对“没有火焰”的现象,能提出的问题是: ;验证方法是: 。
②为了找出铁丝在纯氧中燃烧“火星四射”的原因,其假设和对应验证方法是:
。
③如果探究发现只有含碳细铁丝在纯氧中燃烧才出现“火星四射”现象,你分析其原因是: 。
(3)丙某同学为了验证“铁在氧气的燃烧产物中有Fe2+、Fe3+的存在”,设计并进行了如下实验:

试回答下列问题:
①试剂1是 ,试剂2是 。
②加入新制氯水后溶液中颜色加深是因为(用离子方程式表示)
。
③该同学猜想血红色溶液一段时间后变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为不合理,请提出你的猜想 ,并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
查看答案和解析>>
科目:高中化学 来源:2011届重庆市西南师大附中高三上学期期中考试(理综)化学部分 题型:填空题
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系: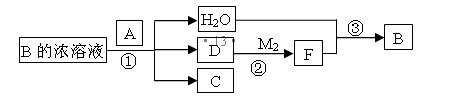
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com