
��15�֣����̫��������û���������ۻ����ϣ���Ħ������Ϊ140 g��mol��1�����й�Ԫ�ص���������Ϊ60%����֪1 molNH3�������Ļ������ҳ�ַ�Ӧ��ɵõ�35 g ����6 g H2����ҵ�����ҵ��������£�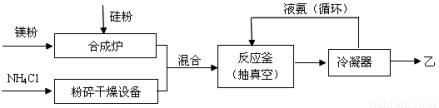 ��ش��������⣺
��ش��������⣺
��1���ҵĵ���ʽ�� ���Ƚ����ȶ��ԣ���_______NH3�����������
��2��NH3�������Ļ������ҷ�Ӧ�ƼĻ�ѧ����ʽ�� ��
��3���ϳ�¯���������ڱ��������¸��ºϳɣ���������������������� ������ĸ��ţ���
A��O2 B��H2 C��N2 D��CO2 E��Ar
��4�����������ҵĹ�����Һ����������______________________________________��
��5����������H2SO4��Һ��Ӧֻ�õ�H2SiO3����M���ֲ��д���÷�Ӧ�����ӷ���ʽ ���������֤������M��ʵ�鷽�� ��
��1��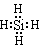 ��2�֣� ����2�֣�����2��3SiH4+4NH3=Si3N4+12H2��2�֣�����3��B��E��2�֣���
��2�֣� ����2�֣�����2��3SiH4+4NH3=Si3N4+12H2��2�֣�����3��B��E��2�֣���
��4��������£�2�֣���5��Si3N4 + 4H++ 9H2O = 3H2SiO3��+ 4NH4+ ��2�֣�
ȡ������Һ���Թ��У��ȼ�ϡ�����������ټ��Ȼ�����Һ���а�ɫ�������ɣ���ȡ������Һ���Թ��У������������ƹ��壨��Ũ��Һ�������ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ����pH��ֽ������ɫ����˵����M�� (NH4)2SO4����3�֣�SO42�����飬��ϡ������������жϸ�1�֣����Ȼ����а�ɫ������1�֣�NH4+����1�֣�
��������
������������ڼ�Ħ������Ϊ140 g/mol�����й�Ԫ�ص���������Ϊ60%��������к���Si��ԭ�Ӹ����ǣ�140��60%����28=3����Ϊ1 molNH3�������Ļ������ҳ�ַ�Ӧ��ɵõ�35 g����6 g H2���������������˺���SiԪ�������NԪ�أ�����1molNԭ��ʱ������14g,��ÿmol�ļ��к���Nԭ�ӵĸ����ǣ���140��35��=4��,4�� Nԭ����3��Siԭ�ӵ����ԭ�����������ĺ���3��28+4��14=140�����ԼĻ�ѧʽӦ����Mg3N4����1mol�İ����к���HԪ�ص�������3g,�����ڻ�ѧ��Ӧ��Ԫ�ص�ԭ���غ㣬���Ի��������к���Si��H����Ԫ�أ�����Si��(35 g��140g/mol)��3=0.75mol,����H��3mol,n(Si)��n(H)= 0.75mol:3mol=1:4,�����һ�ѧʽ��SiH4����1���ҵĵ���ʽ��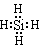 ������Ԫ�صķǽ�����N>Si��Ԫ�صķǽ�����Խǿ������Ӧ��Ԫ�ص��⻯����ȶ��Ծ�Խǿ���������ȶ���SiH4< NH3����2��NH3�������Ļ������ҷ�Ӧ�ƼĻ�ѧ����ʽ��3SiH4+4NH3=Si3N4+12H2����3���ںϳ�¯��Mg��Si������Ӧ����Mg2Si�������ڱ��������¸��ºϳɣ���������������ʲ��ܷ�����Ӧ��A��O2��Mg��Si���ܷ�����Ӧ���������������壬����B��H2 �����ʶ����ܷ�����Ӧ���������������壬��ȷ�� C��N2��Mg�ᷢ����Ӧ�����Բ������������壬���� D��CO2��Mg�ᷢ����Ӧ�����Բ������������壬����E��Ar���κ����ʶ����ܷ�����Ӧ���������������壬��ȷ����4�������������ҵĹ�����Һ����������������£���ֹ���ʷֽ⣻��5����������H2SO4��Һ��Ӧֻ�õ�H2SiO3����M���ֲ������Ԫ���غ���Ӧ��������泥��÷�Ӧ�����ӷ���ʽ��Si3N4 + 4H++ 9H2O = 3H2SiO3��+ 4NH4+����֤������M��ʵ�鷽����ȡ������Һ���Թ��У��ȼ�ϡ�����������ټ��Ȼ�����Һ���а�ɫ��������֤������SO42-����ȡ������Һ���Թ��У������������ƹ��壨��Ũ��Һ�������ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ����pH��ֽ������ɫ����˵������NH4+������M�� (NH4)2SO4��
������Ԫ�صķǽ�����N>Si��Ԫ�صķǽ�����Խǿ������Ӧ��Ԫ�ص��⻯����ȶ��Ծ�Խǿ���������ȶ���SiH4< NH3����2��NH3�������Ļ������ҷ�Ӧ�ƼĻ�ѧ����ʽ��3SiH4+4NH3=Si3N4+12H2����3���ںϳ�¯��Mg��Si������Ӧ����Mg2Si�������ڱ��������¸��ºϳɣ���������������ʲ��ܷ�����Ӧ��A��O2��Mg��Si���ܷ�����Ӧ���������������壬����B��H2 �����ʶ����ܷ�����Ӧ���������������壬��ȷ�� C��N2��Mg�ᷢ����Ӧ�����Բ������������壬���� D��CO2��Mg�ᷢ����Ӧ�����Բ������������壬����E��Ar���κ����ʶ����ܷ�����Ӧ���������������壬��ȷ����4�������������ҵĹ�����Һ����������������£���ֹ���ʷֽ⣻��5����������H2SO4��Һ��Ӧֻ�õ�H2SiO3����M���ֲ������Ԫ���غ���Ӧ��������泥��÷�Ӧ�����ӷ���ʽ��Si3N4 + 4H++ 9H2O = 3H2SiO3��+ 4NH4+����֤������M��ʵ�鷽����ȡ������Һ���Թ��У��ȼ�ϡ�����������ټ��Ȼ�����Һ���а�ɫ��������֤������SO42-����ȡ������Һ���Թ��У������������ƹ��壨��Ũ��Һ�������ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ����pH��ֽ������ɫ����˵������NH4+������M�� (NH4)2SO4��
���㣺���黯������ƶϡ����ʵĵ���ʽ����д�������ȶ��ԵıȽϡ���ѧ��Ӧ����ʽ�����ӷ���ʽ����д��SO42-��NH4+���ӵļ����֪ʶ��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����������и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʼ��ת����ϵ�в���ȫ��ͨ��һ����Ӧ��ɵ���
A��Na��NaOH��Na2CO3��NaCl B��Mg��MgCl2��MgCO3��Mg(OH)2
C��Al��Al2O3��Al(OH)3��AlCl3 D��Fe��FeCl3��Fe(OH)3��Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ������������ȷ���ǣ���
A��1mol Na����ȫ��������Na2O2,ʧȥNA������
B��1��0 L 0��1mol/L��NaAlO2��Һ�к��е���ԭ����Ϊ0��2NA
C��25��pH=13��NaOH��Һ�к���OH������ĿΪ0��1NA
D��1molCl2������������Ӧ��ת�Ƶĵ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤������������������ȷ���ǣ���
A����״���£�11��2LNO��11��2LO2��Ϻ�����������Ϊ0��75NA
B��0��1molNa2O2�������0��3NA������
C��pH=13��1��0LBa(OH)2��Һ�к��е�OH-��ĿΪ0��2NA
D����״���£�22��4L�״��к��е���ԭ����Ϊ1��0NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����и�����������Һ�У�һ���ܴ����������������
A����ɫ��Һ��Ca2����H����Cl����HSO3��
B����ʹpH��ֽ�ʺ�ɫ����Һ��Na+��NH+4��I����NO3��
C��FeCl2��Һ��K+��Na+��SO42����AlO2��
D��  =0.1 mol/L����Һ��Na+��K+��SiO32����NO3��
=0.1 mol/L����Һ��Na+��K+��SiO32����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�������������ۿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
NH3������NO����Ⱦ����Ӧ����ʽΪ��6NO��4NH3 �� 5N2��6H2O������NO��NH3�Ļ����1 mol��ַ�Ӧ������ԭ��������������1.4 g���������ж�����ȷ���ǣ� ��
A����������Ϊ5.6 L
B����0.3 mol NO������
C��������������2.8 g
D��ԭ�������NO��NH3�����ʵ���֮�ȿ���Ϊ3 : 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и���һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��13�֣��л���F���л��ϳɹ�ҵ��һ����Ҫ���м��塣�Լױ��ͱ�ϩΪ��ʼԭ�Ϻϳ�F�Ĺ����������£�
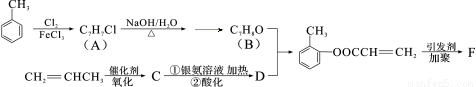
�ش��������⣺
��1��������B�еĺ��������������� ��F�Ľṹ��ʽΪ ��
��2��д��C��������Һ���ȵĻ�ѧ��Ӧ����ʽ�� ��
��3��������D���ܷ����ķ�Ӧ�� ������ţ���
�ټӳɷ�Ӧ ��ȡ����Ӧ ����ȥ��Ӧ ��������Ӧ ��ˮ�ⷴӦ
��4��B�ĺ������ṹ��ͬ���칹�廹�� �֣�����һ�ֵĺ˴Ź��������г���4�����Ҳ���FeCl3��Һ������ɫ��Ӧ���� ����ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ������������ȷ����
A��1mol[Ag (NH3)2]OH������к���9NA���Ҽ�
B����״���£�22.4L C2H6O�к�C��H��5NA
C��1mol�������lmol�Ҵ��ڼ��Ⱥ�Ũ���������³�ַ�Ӧ���ɵ�ˮ������ΪNA
D��KClO3+6HCl ===KCl��3Cl2����3H2O��Ӧ�У�����71g Cl2ʱ��ת�Ƶĵ�����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5(g) 4NO2(g)��O2(g) ��H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±�������˵���в���ȷ����
4NO2(g)��O2(g) ��H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±�������˵���в���ȷ����
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol��L��1) | 5.00 | 3.52 | 2.50 | 2.50 |
A��500 s��N2O5�ֽ�����Ϊ2.96��10��3mol��L��1��s��1
B��T1�¶��µ�ƽ�ⳣ��K1��125
C��T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1��T2����K1��K2
D����ƽ��������������䣬�����������ѹ����ԭ����1/2�����ٴ�ƽ��ʱc(N2O5)��5.00 mol��L��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com