
| A、在标准状况下,22.4L空气中约有NA个气体分子 |
| B、在含4mol Si-O键的石英晶体中,氧原子的数目为2NA |
| C、28g乙烯和28g丙烯中均含有6NA对共用电子对 |
| D、含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3 |


科目:高中化学 来源: 题型:
| A、无色透明的溶液:Na+、I-、SO42-、Fe3+、K+、 | ||
B、
| ||
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、NO3- | ||
| D、常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑥ | B、④⑤⑥ |
| C、①②⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、芳香烃可以来自于煤干馏产品中的煤焦油 |
| B、聚氯乙烯可用于制作食品包装袋 |
| C、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D、在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O (l)+CaO(s)═Ca(OH)2(s) | ||||
| B、Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3?H2O+8H2O | ||||
C、2KClO3
| ||||
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:
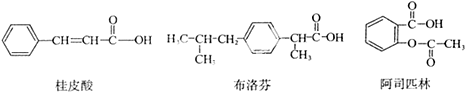
| A、都能与Na2CO3溶液反应产生CO2 |
| B、一定条件下,均能与乙醇发生取代反应 |
| C、只有桂皮酸可与溴的四氯化碳溶液发生加成反应 |
| D、1mol阿司匹林最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH6~9 | 0.5mg?L-1 |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com