
分析 (1)从增大反应速率的影响因素分析,缓慢滴加两种溶液并不断搅拌是让物质充分接触加快反应速率;
(2)①抽滤装置包括吸滤瓶和布氏漏斗;
②检验沉淀已洗涤干净的实验操作是,取最后一次洗涤液,滴入氯化钡溶液,看是否生成白色沉淀分析判断是否洗涤干净;
(3)依据题干信息分析,依据镁离子、铝离子、碳酸根离子物质的量和铝镁加的组成为Al2Mg6(OH)14(CO3)2•4H2O,利用元素守恒分析判断参加反应离子的物质的量,依据全部反应的离子计算生成物的产率=$\frac{实际量}{理论量}$×100%;
(4)铝镁加中和胃酸反应生成二氧化碳、氯化镁、氯化铝和水.
解答 解:(1)将A、B两溶液同时等速滴加到盛有400mL90℃水的2L三颈烧瓶中,维持90℃,不断搅拌,使反应物充分接触,转化为指定产物,
故答案为:使反应物充分接触,转化为指定产物;
(2)①步骤3.抽滤,并用蒸馏水洗涤沉淀3~4次,用到的硅酸盐质仪器是玻璃仪器,主要有布氏漏斗、吸滤瓶,
故答案为:布氏漏斗;吸滤瓶;
②抽滤,并用蒸馏水洗涤沉淀3~4次,证明沉淀已洗涤干净的实验设计为:取最后一次洗涤滤液滴入BaCl2溶液,若无白色沉淀说明已洗涤干净,
故答案为:取最后一次洗涤滤液滴入BaCl2溶液,若无白色沉淀说明已洗涤干净;
(3)称取63.5gMgSO4•7H2O(0.26mol),30.5gAl2(SO4)3•18H2O(0.046mol) 溶于400mL水中得到混合溶液A,另称取无水Na2CO352g溶于400mL水得到溶液B,n(Mg)0.26mol,n(Al)=0.046mol×2=0.092mol,n(CO32-)=$\frac{52g}{106g/mol}$=0.49mol,分析化学式可知,镁元素全部转化到铝镁加,依据镁元素物质的量计算铝镁加的理论量=0.26mol×$\frac{1}{6}$×628g/mol=27.2g,
生成物的产率=$\frac{实际量}{理论量}$×100%=$\frac{24.3g}{27.2g}$×100%=89.3%;
故答案为:89.3%;
(4)铝镁加中和胃酸反应生成二氧化碳、氯化镁、氯化铝和水,反应的化学方程式为:Al2Mg6(OH)14(CO3)2•4H2O+18H+=2Al3++6Mg2++2CO2↑+20H2O,
故答案为:Al2Mg6(OH)14(CO3)2•4H2O+18H+=2Al3++6Mg2++2CO2↑+20H2O.
点评 本题考查了物质制备的实验过程分析判断,化学式的确定,主要是制备步骤和反应产物的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
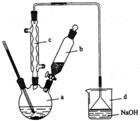 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com