

| 160g |
| 160g/mol |
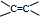 不饱和键,
不饱和键,| 100×37.21% |
| 16 |
| 16×2 |
| 37.21% |
| 160g |
| 160g/mol |
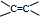 不饱和键,有机物A中氧元素的质量分数为37.21%,相对分子质量不超过100,所以分子中氧原子数目N(O)<
不饱和键,有机物A中氧元素的质量分数为37.21%,相对分子质量不超过100,所以分子中氧原子数目N(O)<| 100×37.21% |
| 16 |
| 16×2 |
| 37.21% |
 ,
, .
.| 86 |
| 14 |


科目:高中化学 来源: 题型:
| A、常温常压下,5.6 g乙烯和环丙烷的混合气体中含有的碳原子数为0.4 NA |
| B、1 mol Cl2通入足量水中反应转移的电子数为NA |
| C、0.1 mol/L Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA |
| D、标准状况下,2.24 L三氯甲烷中含有C-Cl数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电解氧化铝:2Al2O3(熔融)
| ||||
B、电解氯化铜溶液:CuCl2
| ||||
C、电解饱和食盐水:2Na++2Cl-
| ||||
D、电解溴化钠溶液:2H2O+2Br-
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当d极消耗2g H2 时,a极周围会产生22.4L H2 |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、c极上发生的电极反应是:O2+2H2O+4e-=4OH- |
| D、c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解,假设在电解过程中产生的气体全部逸出.下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解,假设在电解过程中产生的气体全部逸出.下列说法正确的是( )| A、甲烧杯中溶液的pH不变 |
| B、乙烧杯中c电极的反应式为:4OH--4e-?2H2O+02↑ |
| C、当b极增重21.6g时,d极产生的气体在标准状况下为2.24L |
| D、当电解足够时间后,将甲、乙两烧杯中的溶液混合,一定会有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com