
【题目】下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH?H2O═AlO2﹣+4NH4++2H2O
B.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O ![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl﹣
【答案】D
【解析】解:A、氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3H2O═Al(OH)3↓+3NH4+ , 题中离子方程式正确,评价不合理,故A错误;
B、向沸水中滴加少量的FeCl3溶液生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,其水解方程式为:Fe3++3H2O
Fe(OH)3(胶体)+3HCl,其水解方程式为:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ , 故B错误;
Fe(OH)3(胶体)+3H+ , 故B错误;
C、醋酸是弱电解质,不能拆,故离子方程式为:CaCO3+2CH3COOH═Ca2++2CH3COO﹣+CO2↑+H2O,故C错误;
D、将氯气通入氯化亚铁溶液中,离子方程式:2Fe2++Cl2═2Fe3+2Cl﹣ , 故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.体积相等、密度不等的CO和C2H4
C.质量相等、密度不等的N2和C2H4
D.压强相同、体积相同的N2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中回顾了十八大以米的五年中国取得的巨大成就,描绘了未来发展的宏伟日标。化学在科学、技术、环境和社会发展中做出了伟大贡献。
(1)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①陶瓷、水泥和普通玻璃都是生活中最常见的材料,它们属于__________。
A.金属材料 B.无机非金属材料 C.有机高分子材料
②纳米铁材料,可以制造出高强度和高韧性的特殊钢材及耐高温的元件(低温性能下降明显),可用于___________。
A.研制新一代蛟龙深潜器的耐压壳体材料
B.研制新一代战机高速发动机中承受超高温的材料
C.研制新一代潜艇容易发生碰撞的舰首和舰尾及尾舵的材料
③钛合金是制造歼-10 飞机和神舟宇宙飞船的理想材科,利纯钛相比,钛合金的强度________(填“低”、“ 高” 或“无法确定”),具有较强的抗腐蚀能力。
④石墨烯被称为“黑金”。是“新材料之王”,科学家甚至预言石墨烯将“彻底改变21世纪”, 石墨烯具有以下超强特性,请用对应性质选择填空
A.导电性 B.导热性 C.机械特性
中科院山西煤炭化学研究所研究应用石墨烯作为超大规模纳米集成电路的散热村科,是应用了石墨烯
的_________(选填序号,下同);中科院上海硅酸盐研究所的研究人员利用细小的管状石墨烯,创造出了一种强度比同重量的钢材要大207倍的泡沫状材料,这种材料应用了石墨烯的_________; 中科院重庆绿色智能技术研究院和中科院宁波材料技术与工程研究所开发了全球首批3 万部石墨烯手机,该款手机采用了最新研制的石墨烯触摸屏、电池,10 分钟可充满6000mAh,这和技术应用了石墨烯的______。
(2)防治环境污染,改善生态环境已成为全球共识。
①下列措施有利于改善环境质量的是___________。
A.禁止秸秆露天焚烧,应抛入内河使其自然腐烂降解
B.垃圾处理不必过细分类,应减少填埋,以焚烧为主即可
C.中国研制出一种纳米乳化剂,以一定比例加入汽油后,可使汽车降低10%左石的耗油量
②正常雨水由于溶解了_________而呈 弱酸性,酸雨是指pH__________的降水。大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因______________。
③石灰法脱硫是以煅烧石灰石得到的生石灰为脱硫剂。在吸收塔中与废气中的SO2反应而将硫固定,其产物可作建筑材料。固硫反应的化学方程式为___________________。
④生态农业涉及农家肥的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体,该气体通过盛有红热CuO粉末的硬质玻璃管,可使甲烷完全转化同时得到紫红色固体,发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙分别盛放的溶液是( ) 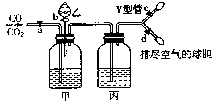
A.饱和NaHCO3 溶液、12molL﹣1盐酸、18.4molL﹣1H2SO4
B.饱和Na2CO3 溶液、2molL﹣1 H2SO4、饱和NaOH 溶液
C.饱和NaOH 溶液、2molL﹣1 H2SO4、18.4molL﹣1H2SO4
D.18.4molL﹣1H2SO4、饱和NaOH 溶液、18.4molL﹣1H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的实验装置用来分离CO2和CO气体并干燥.图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆,现装置内的空气已排尽.为使实验成功,甲、乙、丙中盛放的溶液分别为( ) 
A.NaHCO3饱和溶液、12 molL﹣1 盐酸,18.4 molL﹣1 H2SO4
B.Na2CO3饱和溶液、2 molL﹣1 H2SO4、NaOH饱和溶液
C.NaOH饱和溶液、2 molL﹣1 H2SO4、18.4 molL﹣1 H2SO4
D.18.4 molL﹣1 H2SO4、NaOH饱和溶液、18.4 molL﹣1 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶在生产生活中具有广泛的应用,图甲表示过氧化氢酶催化过氧化氢水解的模型,图乙表示在最适温度和pH条件下,过氧化氢酶的催化速率与过氧化氢量的关系。请回答下列问题:

(1)过氧化氢酶在_________中合成,图1模型能很好地解释了酶具有___________(特性)。
(2)图2中,如果pH分别升高和降低,则催化速率将分别_______、_______(填“升高”“不变”或“降低”)。
(3)不能用过氧化氢酶来探究温度对酶活性的影响,请解释其原因:_________________。
(4)初步测定过氧化氢酶的最适pH在6.0—8.0之间,简要写出测定过氧化氢酶最适pH的实验思路_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究影响过氧化氢分解的因素,做了三个实验,相应的实验结果如图1所示(实验1、 实验2均在最适宜条件下进行,实验3其他条件适宜),请分析回答:
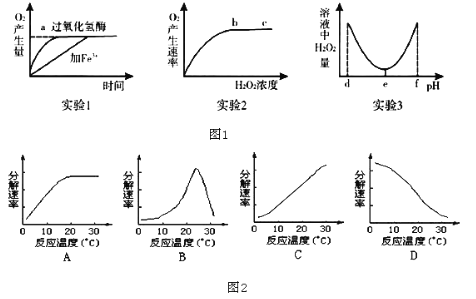
(1)实验1,2,3中的自变量分别为______、______、______。
(2)实验2结果反映,在b、c所对应的H2O2浓度范围内,过氧化氢溶液浓度会______(填“升高”“降低”或“不影响”)过氧化氢酶的活性,bc段O2产生速率不再增大的原因最可能是______。
(3)实验1若温度升高到10℃,加过氧化氢酶的催化反应曲线斜率将______(填“增大”或“减小”);加Fe3+的催化反应曲线斜率将______(填“增大”或“减小”)。
(4)实验3的结果显示,过氧化氢酶的最适pH为______,实验结果表明,当pH小于d或大于f时,过氧化氢的活性将永久丧失,其原因是______。
(5)如图2能正确表示温度对唾液淀粉酶活性影响曲线的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)酶是 产生的具有 一类特殊的有机物,绝大多数酶都是 ,少数酶是 。酶具有降低 的作用。
(2)写出ATP的分子结构简式 。
(3)写出ATP水解的反应式 。写出合成ATP的反应式 。
(4)写出有氧呼吸的总反应式 ,
写无氧呼吸的反应式 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究温度和pH对某酶促反应速率的影响,经实验得到如图所示的曲线。据此图分析,回答下列问题。

(1)该酶催化反应的最适温度为 左右。
(2)当pH为8时,影响反应速率的主要因素是 。
(3)本实验中需控制的无关变量是 (至少写出两个)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com