
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
分析 A、合成氨是发热反应,升温平衡逆向进行;
B、反应是气体体积减小的反应,增大压强平衡正向进行;
C、减小反应物浓度,平衡逆向进行;
D、催化剂同等程度影响正逆反应速.
解答 解:合成氨的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,△H<0,反应是气体体积减小的发热反应,
A、合成氨是放热反应,升温平衡逆向进行,对逆反应的反应速率影响更大,故A错误;
B、反应是气体体积减小的反应,增大压强平衡正向进行,对正反应的反应速率影响更大,故B正确;
C、减小反应物浓度,平衡逆向进行,正反应减小的多,对正反应的反应速率影响更大,故C错误;
D、催化剂改变反应速率,不改变化学平衡,同等程度影响正逆反应速率,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素分析判断,主要是费用特征和平衡移动原理的理解应用,掌握基础是关键,题目较简单.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
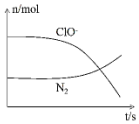 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
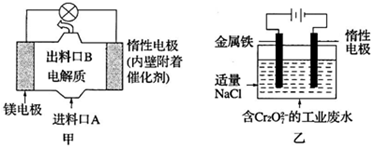
| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n molN2的同时生成n molNH3 | |
| B. | N2、H2、NH3的物质的量浓度比值为1:3:2 | |
| C. | v(N2)=v(NH3) | |
| D. | 单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com