
(9分) 已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
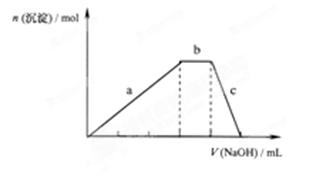
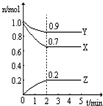
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1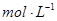 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写b出阶段的离子方程式:
②根据图像判断该盐的化学式为 。
(1)H3O+
(1分) 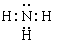 (1分) (2)> (1分)
(1分) (2)> (1分)
(3) Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (2分)
(4)①NH4++OH-= NH3·H2O (2分) ②NH4Al(SO4)2 (2分)
【解析】由②可知N是氨气,M是水,即都是10电子微粒。Y核内质子数比K多2个,所以Y是H3O+,K是OH-。X和Y核内质子总数相等,所以X是NH4+,因此A是H,B是O,C是N。根据⑤可知,Z是铝离子。
(1)氨气是含有极性键的共价化合物,电子式为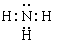 。
。
(2)非金属性越强,氢化物的稳定性越强,所以水的稳定性强于氨气的。
(3)氢氧化铝是两性氢氧化物,但不溶于氨水中,所以方程式为Al3++3NH3·H2O = Al(OH)3↓+3NH4+。
(4)根据图像中沉淀的变化可知,该沉淀是氢氧化铝,因此含有铝离子。A段表示生成氢氧化铝,b段说明该离子能和氢氧化钠反应,所以应该是NH4+。C段表示氢氧化铝的溶解。根据消耗的氢氧化钠体积可判断,两种阳离子的物质的量是相同的,所以该物质是NH4Al(SO4)2。


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:阅读理解
 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:013
|
氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.) | |
| [ ] | |
A. |
H2O2、CuO |
B. |
KMnO4、Na2O |
C. |
NaClO、Cu(OH)2 |
D. |
K2Cr2O7、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铜(CuCl2·2H2O)中含FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
![]()

![]() ↓蒸发结晶
↓蒸发结晶
↓![]() CuCl2·2H2O(纯)
CuCl2·2H2O(纯)
![]() 氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。) ( )
氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。) ( )
![]() A.H2O2、CuO B.KMnO4、Na2O C.NaClO、Cu(OH)2 D.K2Cr2O7、NaOH
A.H2O2、CuO B.KMnO4、Na2O C.NaClO、Cu(OH)2 D.K2Cr2O7、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:

图10-9
(1)化合物B的结构简式为_____________或_____________。
(2)写出反应⑤的化学方程式(有机物写结构简式,下同):
____________________________________________________________________
(3)化合物F的分子式为C6H6O3,它具有酸性,F中只有2种等效氢原子。写出反应⑦的化学方程式:
_____________________________________________________________________
(4)化合物Y是X的同分异构体,Y具有如下特点:a.苯环上有两种取代基;b.苯环上的一氯代物只有两种;c.能跟FeCl3溶液发生显色反应,且1molY能与3molNaOH发生反应。写出符合上述特点的Y的结构简式:__________________________(任写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com