
下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可用电解法制备Mg:MgCl2(熔融)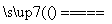 Mg+Cl2↑
Mg+Cl2↑
B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)CaCO3(s)+Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O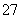 :Cr2O
:Cr2O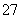 +Fe2++14H+===2Cr3++Fe3++7H2O
+Fe2++14H+===2Cr3++Fe3++7H2O
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:_______________________________________。
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
 Fe3++
Fe3++ SO
SO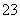 +
+ ________—→
________—→ Fe2++
Fe2++ ________+
________+ ________
________
 乙同学查阅资料得知:
乙同学查阅资料得知:
ⅰ.Fe2+与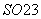 反应生成墨绿色的絮状沉淀FeSO3;
反应生成墨绿色的絮状沉淀FeSO3;
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤Ⅰ中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是______________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液
b.KSCN溶液
c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:________________________________________________________________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO 、S2O
、S2O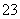
B.澄清透明溶液:Mg2+、Cu2+、Cl-、SO
C.使酚酞变红色的溶液:NH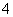 、K+、AlO
、K+、AlO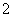 、NO
、NO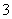
D.含0.1 mol·L-1KI的溶液:Fe3+、Na+、NO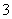 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知非金属元素A最外层电子数与其周期数相同,且A在F中燃烧,产物溶于水得到一种强酸(注:A、F均为短周期元素)。写出一种工业制备单质F的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Ba(OH)2 |
| 非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验所对应的离子方程式正确的是( )
A.向NaAlO2溶液中通入少量CO2:AlO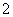 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO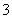
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO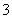 +2OH-===BaCO3↓+CO
+2OH-===BaCO3↓+CO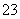 +2H2O
+2H2O
D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-===Fe4[Fe(CN)6]2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
青霉素是一种高效广谱抗生素,经酸性水解后得到青霉素氨基酸分子,其结构简式如图。下列关于该物质的叙述不正确的是( )
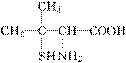
A.属于α氨基酸
B.能发生加聚反应生成多肽
C.核磁共振氢谱上共有5个峰
D.青霉素过敏严重者会导致死亡,用药前一定要进行皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
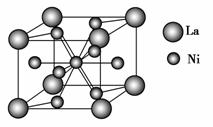
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com