
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
【答案】A
【解析】
①盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,由于Mg2+水解Mg2++2H2OMg(OH)2+2H+,加热蒸发时HCl挥发,平衡向右移动,所以得不到无水MgCl2,故①错误;
②氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故②错误;
③氨催化氧化生成一氧化氮和水,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,符合各步转化,故③正确;
④电解氯化钠溶液生成氢气、氢氧化钠和氯气,氯气与铁反应只能生成氯化铁,得不到氯化亚铁,故④错误;
⑤硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故⑤错误;
⑥SiO2与氢氧化钠反应Na2SiO3,Na2SiO3中通二氧化碳发生反应生成H2SiO3,符合各步转化,故⑥正确;
故③⑥正确,故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为 CuCO3Cu(OH)2、CuSiO32H2O,含 SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
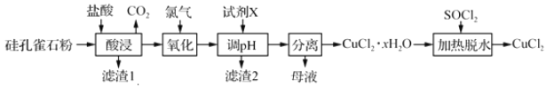
已知:SOCl2+H2O ![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为________________,为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③_________;
(2)滤渣2的主要成分为___________(填化学式);
(3)“氧化”时发生反应的离子方程式为__________________________;
(4)试剂X的作用是调节溶液的pH,试剂X可以是_____;“调pH”时,pH不能过高,其原因是_______________;
A.CuSO4 B.Cu2(OH)2CO3 C.NaOH D.CuO
(5)“加热脱水”时,加入SOCl2的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A. 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-)
B. pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 0.1mol·L-1HCl溶液与0.2 mol·L-1 NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D. 0.1mol·L-1K2C2O4溶液与0.2 mol·L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)+c(H2C2O4) ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
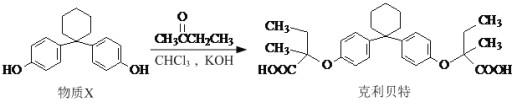
下列有关叙述正确的是
A. 克利贝特的分子式为C28H34O6
B. B.物质X分子中所有碳原子可能位于同一平面内
C. 用NaOH溶液可以鉴别物质X和克利贝特
D. 物质X中无手性碳原子,克利贝特中有两个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
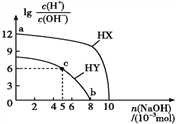
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把4molA和5molB混合充入容积为2L的恒容密闭容器里,发生如下反应:4A(g)+5B(g)![]() xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
A.达到平衡状态时C的产率为60%
B.x=4
C.只要混合气体的密度保持不变,就一定达到化学平衡状态
D.达到平衡状态时容器内气体的压强与起始时压强比为16:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:①![]() H与
H与![]() H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与
H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与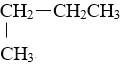 ⑤C60与C70
⑤C60与C70
(1)互为同位素的是______(填编号,下同);
(2)互为同素异形体的是______
(3)互为同分异构体的是______
(4)属于同一种物质的是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com